
21.(10分)(1)< (2分)
(2)CH4(g)+2O2(g) =CO2(g)+2H2O(l) △H=-890kJ/mol(2分)
(3)B(2分) 2mol (2分)
(4)CH4+10OH--8e-=CO32-+7H2O (2分)
21(8,9,10班学生做)(1)6 12 正八面 1︰1 (2)50%
(3)从图中可看出a=2(r-+r+),∴r-+r+=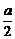 ,即NaCl晶体中离子键键长为
,即NaCl晶体中离子键键长为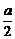 。
。
(4)不难看出ΔABC为等腰直角三角形,

即 整理得:
整理得:
(5)氯化钠气体的物质的量=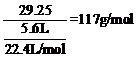 ,设氯化钠气体分子式为(NaCl)n,则58.5n=117,n=2。即氯化钠气体的分子式(化学式)为Na2Cl2。
,设氯化钠气体分子式为(NaCl)n,则58.5n=117,n=2。即氯化钠气体的分子式(化学式)为Na2Cl2。
20.(8分)(1) Al略 (1分)
(2)E:Cl2 (1分) K:Fe(OH)3 (1分)
(3)共价 (1分)
(4)Al(OH)3 + NaOH = NaAlO2 + 2H2O (2分)
(5) 2Fe2+ + Cl2 = 2Fe2++2Cl- (2分)
19.(8分)(1)H2(1分) Zn+2H+=Zn2++H2↑(1分)网
(2)①NaOH溶液(1分) 浓H2SO4(1分)②黑色固体变红(1分) 无水CuSO4(1分)
(3)SO2为0.4mol,H2为0.1mol(2分)
18.(6分) (1)2(2分)(2) mol/(L·min ) (2分)(3)C、E(2分)
mol/(L·min ) (2分)(3)C、E(2分)
18(8,9,10班学生做)(1)原子晶体 (2)As2S5
(3)①NH3> AsH3 > PH3
②电子数相同的有SiH4、PH3和H2S结构分别为正四面体,三角锥和V形
(5)SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4 = 8NH3 + Si3N4
17.(4分)(1)Na (2)F2 (3)金刚石 (4)Cl日
24.(8分)含有1mol HNO3的稀硝酸溶液与铁粉反应,所得氧化产物a、b的物质的量与加入
 铁粉物质的量关系如图所示(其中p、q、r为氧化产物的物质的量,n1、 n2 、n3为加入
铁粉物质的量关系如图所示(其中p、q、r为氧化产物的物质的量,n1、 n2 、n3为加入
铁粉的物质的量)。请回答以下问题:
(1)氧化产物a是________ b是_______
(2)P=___________________
(3)n1=________ n2=_________
写出(2)、(3)计算过程:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
A |
B |
C |
C |
D |
C |
D |
C |
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
C |
BC |
D |
BD |
A |
BC |
B |
C |
23.(6分)硫酸和盐酸组成的混合液100 mL,与3.42g氢氧化钡粉末恰好完全反应后溶液呈
中性。反应后经过滤、洗涤、干燥,得到沉淀2.33g。则分别计算原混合液中硫酸和盐酸
的物质的量的浓度。(设溶液总体积始终不变)
22.(10分)A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核
内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化
物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳
离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置 _______________
(2)工业合成BA3的化学方程式为 ____________________________________________
(3)D2C2含有的化学键是 _______________________________
(4)由A、B、C三种元素形成的离子化合物与强碱溶液反应的离子方程式是_________
(5)某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反
应的化学方程式为(化学式用具体的元素符号表示)_______________________
21. (10分)(8,9,10班学生做)由阴阳离子通过离子键结合而成的晶体称为离子晶体,离子化合物固态时一般为晶体,在离子晶体中,阴、阳离子按一定规律在空间排列。右图是NaCl晶体的晶胞结构。
(10分)(8,9,10班学生做)由阴阳离子通过离子键结合而成的晶体称为离子晶体,离子化合物固态时一般为晶体,在离子晶体中,阴、阳离子按一定规律在空间排列。右图是NaCl晶体的晶胞结构。
(○为Cl- ●为Na+)
(1)在NaCl晶体中,每个Na+离子同时吸引着_________个Cl-离子,在Cl-周围与它最接近且等距离的Cl-共有
_________个,Cl-离子位于Na+围成的__________体中心,而Na+离子数目与Cl-离子数目之比为___________。
(2)若CuO晶体中O2-采取NaCl晶胞结构中Na+的堆积方式,Cu2+占据O2-围成的正四面体空隙,则Cu2+占据O2-围成的正四面体空隙的占据率为 __________。
在离子晶体中,阴、阳离子具有或接近具有球形对称的电子云,它们可以被看成是不等径的刚性圆球,并彼此相切(如下图),离子键的键长是相邻阴、阳离子的半径之和(如下图)。已知a为常数。试回答下列问题:


NaCl晶体中微粒间排布 NaCl晶体中离子键键长
(3)NaCl晶体离子键的键长为____________。
(4)Na+离子半径与Cl-离子半径之比 =_______________。
=_______________。
(已知 )
)
(5)NaCl晶体中不存在分子,但在温度达到1413℃时,NaCl晶体形成气体,并以分子形成存在,现在29.25g NaCl晶体,强热使温度达到1450℃,测得气体体积为5.6L(已折算为标准状况),则此时氯化钠气体的分子式(化学式)为____________。
21.(10分)已知在250C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,
请回答下列问题:
(1)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 ___(填“>”、“<”或“=”)570 kJ
(2)现有250C、1.013×105Pa下的H2和CH4的混合气体0.5mol,完全燃烧生成一定质量
的CO2气体和10.8gH2O(l),放出203kJ的热量,则1molCH4 完全燃烧生成CO2
气体和H2O(l)的热化学方程式为 ____________________________________ 。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右图所示:A、B两个电极
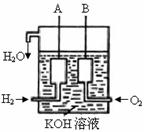 均由多孔的碳块组成。
均由多孔的碳块组成。
该电池的正极为:__________(填A或B)。若该电池工作时增加了1mol H2O,电
路中转移电子的物质的量为 ____________ 。
(4)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电池装置,电池的
总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,则该电池的负极反应式
为:______________________________________________________________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com