
7、下列关于铜电极的叙述正确的是( )
A.铜锌原电池中铜是正极 B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时可用金属铜作阳极 D.电解稀硫酸制H2、O2时铜作阳极
6、在铁制品上镀上一定厚度的锌层,以下设计方案正确的是 ( )
A.锌作阳极,镀件作阴极,溶液中含有锌离子 B.铂作阴极,镀件作阳极,溶液中含有锌离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子D.锌用阴极,镀件作阳极,溶液中含有锌离子
5、可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列4个反应 ①Br2+2e=2Br-②2Br-2e=Br2③Zn-2e=Zn2+
④Zn2++2e=Zn其中表示充电时的阳极反应和放电时的负极反应的是 ( )
A ②和③ B ②和① C ③和① D ④和①
4、用惰性电极实现电解,下列说法正确的是 ( )
A 电解稀硫酸溶液,实质上是电解水,故溶液p H不变
B 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C 电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
3、用惰性电极电解下列溶液一段时间,再加入一定量的一种纯净物质(方括号内)后,假定产生的气体全部逸出,能使电解后的溶液与原来溶液的成分、浓度都相同的是 ( )
A.CuCl2[CuCl2] B.NaOH[NaOH] C.NaCl[HCl] D.CuSO4[Cu(OH)2]
2、X、Y、Z、M代表四种金属元素。金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为 ( )
A. X>Z>Y>M B. X>Y>Z>M C. M>Z>X>Y D. X>Z>M>Y
1、pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )
A、NaoH B、H2SO4 C、AgNO3 D、Na2SO4
13、冶炼Na、Mg、Al等较活泼的金属:
反应原理分别是 ; ; 。
14:电解总结:
阳极:发生氧化反应 还原性强的先反应 还原性顺序为:
活性电极>S2->I->Br->Cl->OH->含氧酸根离子>F-
阴极:发生还原反应 氧化性强的先反应
Ag+>Fe3+>Cu2+>H+(酸)>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Na+>Ca2+>K+>活性电极
注意:(1)阳极若是活性电极,则是活性电极失去电子被氧化,若为惰性电极则考虑阴离子放电
(2)阴极任何时候都是阳离子放电
典型例题:
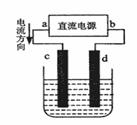 例1:(2004,上海)右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
例1:(2004,上海)右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中、d电极质量增加
D.电解过程中,氯离子浓度不变
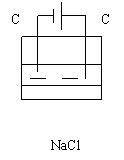 例2:写出右图的电极反应:阴极:
例2:写出右图的电极反应:阴极:
 总方程式: 。电子的流向:
总方程式: 。电子的流向:
实现的能量转化是:
随着电解的进行溶液的pH将会: (填升高,减低或不变)
若让电解后的溶液恢复到原来的浓度,应该加的物质是: 。
若电解前NaCl溶液的体积是500ml,电解的结果,阳极得到标准状况下11.2ml
的气体,则电解后溶液的pH为: (溶液体积变化不计)。
请分析氢氧化钠在哪个极上产生的,原因是:
例3:金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e- == Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
 C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
例4:铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 。
(2)铝与氢氧化钾溶液反应的离子方程式是 。
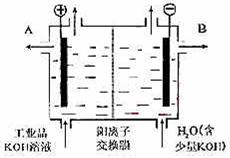
(3)工业品氢氧化钾的溶液中含有某些含氧酸根
杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜
(只允许阳离子通过),其工作原理如图所示。
①该电解槽的阳极反应式是 。
②通电开始后,阴极附近溶液pH会增大,请
简述原因 。③除去杂质后的氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
例5:(09全国卷一)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和l00 g 10.00%的K2SO4溶液,电极均为石墨电极。
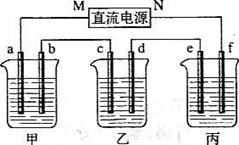
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状况下的体积: ;
④电极c的质量变化是 g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ;
乙溶液 ;
丙溶液 ;
(2)如果电解过程中铜全部析出.此时电解能否继续进行,为什么?
。
强化训练:
12、 氯碱工业:
氯碱工业:
①.电极材料:阳极 ,阴极 。
②电极反应及总反应: 。
阳极 ,
阴极 ,
阴极周围PH 。
③设备:立式隔膜电解槽
④粗盐水的精制:粗盐水中含有Ca2+、Mg2+、SO42-等杂质,为了有效的除去Ca2+、Mg2+和SO42-,可加入的试剂依次是 。
11、精练铜: 作阳极, 作阴极,电解质为 。粗铜中含有Zn、Fe、Ag、Au等杂质,阳极泥中会有 。电解质的浓度有无变化?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com