
18、(09朝阳)按右图所示装置连接,X、Y均为惰性电极。

请回答:
(1)Zn为 极,其电极反应式为 。
(2)接好装置后,烧杯中的溶液发生反应的离子方程式是 。
(3)上图中通过膈膜的SO42-向 (填“左”“右”或“不”)迁移,Y极及其附近出现的现象 。
(4)常温下当Zn极质量减少32.5 g时,X极生成气体8.4 L(标准状况),若此时烧杯中溶液的体积为500 mL, 则此时烧杯中溶液的pH = (不考虑生成的气体溶于水)。
17、(09东城)如下图装置,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹,电源a、b两极。若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电,电解一段时间后A、B中均有气体如图所示。

(1)电源的a极为 (填正、负极)。
(2)在湿的Na2SO4滤纸条中心滴KMnO4液滴,现象是 。
(3)写出A中电极反应式 。
(4)若电解一段时间后A、B中均有气体包围电极。此时切断K2、K3,闭合K1电流表
的指针偏转,此时B极电极反应式为 。
16、(09宁夏卷 37)
37) 请回答氯碱的如下问题:
请回答氯碱的如下问题:
 (1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
 (2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)

 (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
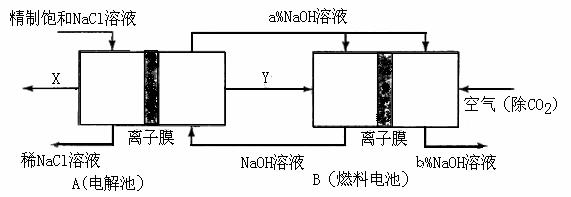
 ①图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
①图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
 ②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
 ③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
15、由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所法实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
①a电极材料为_______,其电极反应式为_______________________。
②电解液d可以是_______,则白色沉淀在电极上生成;也可以是_______,则白色沉淀在两极之间的溶液中生成。

A.纯水 B.NaCl 溶液 C.NaOH溶液 D.CuCl2溶液
③液体c为苯,其作用是________________,在加入苯之前,对d溶液进行加热处理的目的是_________。
④为了在短时间内看到白色沉淀,可以采取的措施是________________________。
A.改用稀硫酸做电解液 B.适当增大电源电压
C.适当缩小两电极间距离 D.适当降低电解液温度
⑤若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为________________________________。
14、(09北京崇文)如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。

请回答:
(1)B极是电源的 ,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 ,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是 溶液。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为 ,甲中溶液的pH (填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是 。
13、右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:

(1)直流电源中,M为 极。
(2)Pt电极上生成的物质是 ,其质量为 g。
(3)电源输出的电子,其物质的量与电极b、c、d分 别 生成的物质的物质的量之比为:2∶ ∶ ∶ 。
(4)AgNO3溶液的浓度(填增大、减小或不变。下同) ,AgNO3溶液的pH ,H2SO4溶液的 浓度 ,H2SO4溶液的pH 。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为 g。
12、1LK2SO4、CuSO4的混合液中c(SO42-)=2mol/L,用用石墨作阳极此溶液,通电一段时间后,两极均收集到(标准状况下)22.4L气体,则原溶液中K+浓度为( )
A.0.5mol/L B.1mol/L C.1.5mol/L D.2mol/L
11、 某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,
某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,
通电时,为使氯气被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,
则对电源电极名称和消毒液的主要成分判断正确的是( )
A、a为正极,b为负极;NaClO和NaCl B、a为负极,b为正极;NaClO和NaCl
C、a为阳极,b为阴极;HClO和NaCl D、a为阴极,b为阳极;HClO和NaCl
9、能够使反应Cu+2H2O Cu(OH2)↓+H2↑发生,且Cu(OH)2能在电极上析出的是( )
A.铜片作原电池负极,碳棒作原电池正极,电解质溶液为NaCl溶液
B.用铜片作阴、阳极,电解Na2SO4的水溶液 C.用铜片作阴、阳极,电解NaOH的水溶液
D.用铜片作阴、阳极,电解CuSO4的水溶液
8、将质量分数为0.052(5.2%)的NaOH溶液1 L(密度为1.06 g·cm-3)用铂电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是( )
|
|
NaOH的质量分数 |
阳极析出物的质量/g |
阴极析出物的质量/g |
|
A |
0.062(6.2%) |
19 |
152 |
|
B |
0.062(6.2%) |
152 |
19 |
|
C |
0.042(4.2%) |
1.2 |
9.4 |
|
D |
0.042(4.2%) |
9.4 |
1.2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com