
2.下列有关动物胚胎发育和胚胎工程的叙述正确的是
A.婴儿的诞生标志着人体个体发育的开始
B.酵母菌的个体发育包括胚胎发育和胚后发育
C.体外受精完成后即可进行胚胎移植操作
D.胚胎干细胞经核移植形成重建细胞发育成新个体属于有性生殖
1.下列各种物质中不可能是存在于相关膜结构上的蛋白质的是
A.酶 B.载体蛋白 C.抗体 D.性激素
20.(8分)国际原油价格居高不下,能源压力增大,同时全球 气候变暖,生态环境问题日益突出。世界自然基金会为中国支招,大力发展可再生能源,提高能源利用率。基于此,有专家建议:四川盛产红薯,以红薯为原料生产乙醇,将乙醇和汽油按一定比例混配作为燃料,可缓解能源供应紧张的矛盾。请回答下列问题:
(1)已知4.6g乙醇完全燃烧生成 CO2 和液态水放出热量 136kJ ,请写出乙醇燃烧的热化学方程式____________________________________________________。
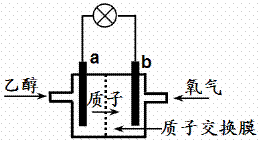
(2)发展燃料电池可减少有害气体的排放,04年美国科学家研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电。电池总反应为:C2H5OH + 3O2==2CO2 + 3H2O,电池示意图如右。试写出a极的电极反应式:
___________________________________。
(3)血液中含乙醇0.1%会使视觉敏感度降到32%,因此交通法规定严禁酒后驾车。一种简便的检测方法是让驾车人呼出的气体接触含有经硫酸酸化处理的强氧化剂(CrO3)的硅胶,如果呼出的气体含乙醇蒸汽,乙醇会被氧化生成乙醛,同时CrO3被还原为硫酸铬(Cr2(SO4)3),请写出检测时反应的化学方程式______________________。
(4)一定量的乙醇在氧气不足的情况下燃烧,得到的CO、CO2和水蒸汽的总质量为27.6g,其中水的质量为10.8g,常温下若将该产物通入到350mL 2mol·L-1的氢氧化钠溶液中,则所得溶液中各离子的浓度由大到小的顺序为:___________________________。
19.(12分)已知A至O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。

已知:A、B、H分别是由短周期元素组成的单质。B与冷水难反应,与沸水可反应放出氢气。
是一种离子化合物,其阴阳离子的个数比为2:3,且D能与水反应得到两种碱。C为淡黄色固体化合物,可做防毒面具的供氧剂,O能与G的水溶液反应生成蓝色沉淀。
请回答下列问题:
(1)组成B单质的元素位于周期表第______周期,第_____族。化合物C的电子式为_____________________。
(2)J的沸点比硫化氢的沸点高,其原因是__________________________________________。
(3)写出D与足量的N反应生成E和F的化学方程式:________________________________。
 (4)上图中,在同一反应里一种物质既作氧化剂又作还原剂,这样的反应共有_______个。
(4)上图中,在同一反应里一种物质既作氧化剂又作还原剂,这样的反应共有_______个。
18.(16分)Ⅰ.在一定条件下,xA + yBzC,达到平衡,试填写下列空白:
(1)已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向________方向移动。
(2)若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为_______。
Ⅱ.下图中,P为一可自由滑动的活塞,关闭 K ,向容器甲中充入6mol A和6molB、乙中 充入3mol A和3 molB,起始时,V甲 = 2a L ,V乙 = 1.2a L (连通管的体积忽略不计),在相同温度和催化剂存在的条件下,容器中各自发生下述反应:
充入3mol A和3 molB,起始时,V甲 = 2a L ,V乙 = 1.2a L (连通管的体积忽略不计),在相同温度和催化剂存在的条件下,容器中各自发生下述反应:
A ( g ) + B ( g ) C ( g )
C ( g )
 达到平衡时V乙= 0.8 a L 。试回答下列问题:
达到平衡时V乙= 0.8 a L 。试回答下列问题:
(1)在一定条件下上述反应能够自发进行,则反应的△H____0(填写“>”、“<”、“=”)。
(2)该反应的平衡常数表达式:K(甲)=________(用a表示);甲、乙两个容器达到平衡的时间t(甲)_____t(乙)(填“>”、“=”、“<”)
(3)平衡时,乙中B的转化率为________;当甲、乙分别达到平衡时,两个容器中物质C的百分含量的关系:甲________乙(填“>”、“=”、“<”)
(4)如果要计算出平衡时乙中混合气体的密度,则至少还需要知道的数据是________(MA、MB、MC分别表示A、B、C的摩尔质量)①MA ②MB ③MC
A.③ B.①② C.①③ D.①②③
(5)若开始时打开K再向A、B中充入气体,一段时间后反应达到平衡,则乙的体积为_____。
(6)若以原甲中的反应为Ⅰ、乙中的反应为Ⅱ、打开K混合后的反应为Ⅲ,请在右图中画出三种情况下c(B)(B的物质的量浓度)随时间变化的趋势图。
17.(12分)某无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子。
①经实验知溶液明显呈酸性,且焰色反应呈现出紫色。
②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀,向滤液中加入AgNO3溶液未见沉淀产生。
③另取少量该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后沉淀完全溶解。
(1)该溶液中一定不含有__________________离子,一定含有__________________离子(统一填离子的化学式)。
(2)为确定上述溶液中所含的各种离子的物质的量, 取100mL上述溶液并向其中加入Na2O2固体,产生的沉淀和气体与所加Na2O2固体物质的量的关系曲线如右图:
①该溶液中Al3+的物质的量大小为:____________;NH4+的物质的量大小为:__________。
该溶液中焰色反应呈现紫色的离子的物质的量为:____________mol。
②写出n(Na2O2)=0.2mol时反应的总离子方程式:__________________________________;
16. (7分)将0.2mol·L-1 HA溶液与0.2mol·L-1 NaOH溶液等体积混合,混合液中c(Na+)>c(A-),则(用“>”、“<”或“=”填写下列空白)。
(7分)将0.2mol·L-1 HA溶液与0.2mol·L-1 NaOH溶液等体积混合,混合液中c(Na+)>c(A-),则(用“>”、“<”或“=”填写下列空白)。
(1)混合溶液中c(HA)_______c(A-);(2)混合溶液中c(HA)+c(A-)______0.1mol/L;
(3)混合溶液中由水电离出的c(OH-)______0.2mol·L-1 HA溶液中由水电离出的c(H+);
(4)25℃时,如果取0.2mol·L-1 HA溶液与0.11mol·L-1 NaOH溶液等体积混合,混合液pH<7,则混合液中HA的电离程度______NaA的水解程度。
(5)某温度下,FeB(s) Fe2+(aq)+B2-(aq),FeB在水中
Fe2+(aq)+B2-(aq),FeB在水中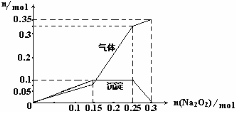 的沉淀溶解平衡曲线如下图所示。
的沉淀溶解平衡曲线如下图所示。
下列说法错误的是_____________
A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由a点变到c点
D.此温度下,KSP=4×10-18
15.下列叙述正确的是
A.pH相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]
< c[(NH4)2SO4] < c(NH4Cl)
B.因为AgI的溶解度小于AgCl的溶解度,所以向AgI悬浊液中滴入KCl溶液,不能生成AgCl沉淀
C.0.2mol/L HCl溶液与等体积0.05mol/L
Ba(OH)2溶液混合后,溶液的pH=1
D.0.2mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=c(CO32-)+c(OH-)

第Ⅱ卷
本卷有5小题,共55分。
14.常温下,将V1mL
c1 mol/L的醋酸溶液滴加到V2
mL c2 mol/L的氢氧化钠溶液中,下列结论正确的是:
A.若V1=V2 ,且溶液的pH>7,则一定有c1<c2
B.若混合液的pH=7,则一定有c1v1>c2v2
C.若混合液的pH=7,则混合液中c(CH3COO-)>c(Na+)
D.若c1V1=c2V2,则混合溶液中有c(OH-)>c(CH3COOH)+c(H+)
13.一定温度下,在体积为VL的密闭容器中加入3molX进行如下反应:
3X(g) 2Z(g)+W(s);△H>0达到平衡,下列判断正确的是:
2Z(g)+W(s);△H>0达到平衡,下列判断正确的是:
A.向平衡混合物中加入少量W,正、逆反应速率均增大
B.平衡后再加入1molX,上述反应的△H增大
C.温度不变,再加入2
molX,重新达到平衡时X的转化率大于原平衡
D.当容器中混合气体的密度不变时不能证明此反应已达到平衡状态
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com