
1.以下关于商鞅变法的评价,正确的是: ( )
①废除了奴隶主贵族的世袭特权,促进了封建经济的发展
②为后来秦统一六国奠定了基础
③严刑峻法和文化高压政策,为后来的秦朝产生了消极影响
④由于商鞅遭到车裂之刑,导致变法的失败
A.①②③ B.①②④ C.①② D.①②③④
29、(11分)某短周期元素A,其最高价氧化物对应水化物甲与其气态氢化物乙反应可生成盐丙。已知乙的密度是同温同压下H2密度的8.5倍。请回答:
(1)工业合成乙时,所选择的适宜反应条件是 。生成0.1mol乙时放出热量为a kJ,该反应的热化学方程式为
。
(2)在一定条件下,将乙放入固定容积的密闭容器中使其发生分解反应,已知△H>0,达到平衡状态后,改变其中一个条件X,Y随X的变化符合图中曲线的是 。
 A.当X表示温度时,Y表示乙的物质的量
A.当X表示温度时,Y表示乙的物质的量
B.当X表示压强时,Y表示乙的转化率
C.当X表示反应时间时,Y表示混合气体
|
D.当X表示乙的物质的量时,Y表示某一生成物的物质的量
(3)现有硫酸和甲的混合液20mL,其中硫酸的物质的量浓度为2mol·L-1,甲的物质的量浓度为1mol·L-1。向该混合液中加入0.96g铜粉,假设只生成一种无色气体,则所收集到的气体的体积在标准状况下为 。
(4)丙对水的电离起 作用(填“抑制”、“促进”或“不影响”),原因是(结合离子方程式简要说明)
。
永安一中2009-2010学年上学期半期考
28、(11分)回答下列各题:
(1)在探究原电池中电极与电解质溶液之间的关系时,某同学设计了用铝片、铜片作电极,用浓硝酸作电解质溶液的原电池,则铜片为原电池的 极,铝片上的电极反应式为 。
(2)通过 装置可以实现Cu + 2H2O == Cu(OH)2 +H2↑反应,该装置应以铜为 极,并可选用下列溶液中的 为电解质溶液。
A. 硫酸溶液 B.氢氧化钠溶液 C.硫酸铜溶液 D.氯化钠溶液
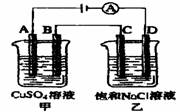 (3)如右图所示的两个电解槽中,A、B、C、D均
(3)如右图所示的两个电解槽中,A、B、C、D均
为石墨电极。电解过程中,乙中反应的离子方程式
。
若乙烧杯中D极上产生224mL标准状况下的气体,则
甲烧杯中B极上可析出铜 g(铜的相对原子质
量为64)。
27、(12分)回答下列各小题:
(1)已知NaHSO4在水中的电离方程式为 NaHSO4 == Na+ + H+ + SO42- 。在NaHSO4溶液中c(H+) c(OH-)+ c(SO42-)(填 “>”、“=”或“<”)。
 (2)常温下,向1.0mol / L的NaHSO4溶液中逐滴加入等物质的量浓度的Ba(OH)2溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图
(2)常温下,向1.0mol / L的NaHSO4溶液中逐滴加入等物质的量浓度的Ba(OH)2溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图
所示。a、b、c、d分别表示实验时不同阶段的溶液。
其中b点所示溶液呈 (填“酸性”、
“中性”或“碱性”),c点所示的离子方程式为
。
(3)在t℃时,将NaHSO4晶体加入到pHH= 6的蒸馏水中,保持温度不变,测得溶液的pHH为2。t℃将 25℃(填“高于”或“低于”),Kw为 ,在该溶液中由水电离出的c(H+)为 mol / L。t℃时,将pH =11的NaOH溶液V1L与pH =1的H2SO4溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH =2,则V1∶V2 = ,此溶液中各种离子的浓度由大小的排列顺序为 。
(4)0.1mol / L pH为4的NaHB溶液中①c(H2B)、②c(HB-)、③c(B2-)由大到小的顺序为 。
(5)在0.1mol / L的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4HSO4溶液、④NH4Cl溶液中,c (NH4+)由大到小的排列顺序为 。
26、(8分)在100℃时,将0.100
mol的N2O4气体充入1 L真空的密闭容器(恒容)中,已知容器中的反应为 N2O4(g) 2NO2(g);ΔΗ>0 。每间隔20s对该容器内的物质进行分析,得到数据如下表,请回答:
2NO2(g);ΔΗ>0 。每间隔20s对该容器内的物质进行分析,得到数据如下表,请回答:
|
时间(s) 浓度(mol / L) |
0 |
20 |
40 |
60 |
80 |
|
c(N2O4) |
0.100 |
a |
0.050 |
c |
d |
|
c(NO2) |
0.000 |
0.060 |
b |
0.120 |
0.120 |
(1)20s时N2O4浓度a = ;在0 ~20 s内N2O4的平均反应速率为
;表中b c d(填“>”、“<”或“=”)。
(2)该反应到达平衡时N2O4的转化率为 ;若对该平衡混合气进行加热,则其平均相对分子质量将 (填“增大”、“减小”或“不变”)。
(3)若在相同条件下,最初向该容器充入的是NO2气体,要达到上述同样的平衡状态,NO2的起始浓度应为 。
(4)若在相同条件下,往原平衡体系中再通入0.20mol NO2气体,重新达到平衡时容器内的NO2物质的量为 。
A、大于0.12mol ,小于0.24mol B、等于0.24mol
C、大于0.24mol ,小于0.32mol D、等于0.32mol
25、(10分)A、B、C、D都是短周期元素,它们的原子序数依次增大。已知:元素A的原子最外层电子数是最内层电子数的两倍;元素B是地壳中含量最高的元素;元素B、C的原子的最外层电子数之和等于元素D的原子的最外层电子数。甲、乙两种化合物分别由元素C与B、C与D组成。甲与水反应或者电解乙的水溶液,都将得到可溶性化合物丙。丙是一种离子化合物,构成该物质的阴、阳离子都含10个电子。回答下列问题:
(1)A原子的结构示意图为 ;B元素在周期表中的位置为 ;
甲中一定含有的化学键为 ;丙的电子式为 ;D的单质的结构式为 ;A与B所形成稳定化合物的分子为 分子(填“极性”或“非极性”)。
(2)当甲与水的反应生成气体时中,其还原剂是 ,1mol甲参与反应时转移电子为 mol。
(3)由A、B、C三种元素所组成的常见化合物,在水中发生水解反应的离子方程式为:
。
24、已知A2On2-可与B2-反应,B2-被氧化成B单质,A2On2-被还原成A3+,且知50mL、0.3mol / L的A2On2-溶液与150 mL、0.3mol / L的B2-溶液恰好完全反应,则n值为
A.4 B.5 C.6 D.7
23、
 在容积可变的密闭容器中存在如下反应:2A(g)+2B(g) C(g) +3D(g);△H<0。该可逆反应的反应速率-时间、转化率-时间关系图如下:
在容积可变的密闭容器中存在如下反应:2A(g)+2B(g) C(g) +3D(g);△H<0。该可逆反应的反应速率-时间、转化率-时间关系图如下:
下列分析中不正确的是
A.图I可体现t0时升高温度对反应速率的影响
B.图II可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图III可体现催化剂对化学平衡的影响,且甲使用了催化剂
D.图III可体现温度对化学平衡的影响,且乙的温度较高
22、从下列事实所引出的相应结论,正确的是
|
选项 |
实验事实 |
结论 |
|
A |
等体积pH同为3的酸HA和酸HB与足量Zn反应,酸HA放出氢气多 |
酸性:HA > HB |
|
B |
Na2SO4溶液的pH小于Na2CO3溶液的pH |
非金属性:S > C |
|
C |
电解同浓度的A2+和B2+硝酸盐的混合溶液,A先析出 |
金属性:A > B |
|
D |
由M、N与稀硫酸构成的原电池中,M上产生大量气泡 |
金属性:M > N |
21、关于SnCl4是离子晶体,还是分子晶体,以往曾有过争议。根据你所学的知识,你认为最好通过下列何种实验来确定其晶体类型
A.测其熔点高低 B.测其硬度大小
C.测其水溶性 D.测其熔融物的导电性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com