
0.55 g×10% x
==
X=0.033g
(2)消耗盐酸的体积为=0.5mL
(3)它是微型实验用药量的=10(倍)
答:略
17、解:(1)设生成二氧化碳的质量为x。
CaCO2+2HCl=CaCl2+H2O+CO2↑
73 44
16、(1)解:设加水后溶液的质量为x
10g ×98%= x×19.6%
x =50g
需要水的质量=50g一l0g =40g
(2)解:设生成氢气的质量为x
Zn+H2SO4=ZnSO4 + H2↑
98 2
20g ×19. 6% x
 x
=0. 08g
x
=0. 08g
答:略。
15、(1)95
(2)m(NaOH)= 4.8g×5% =0.24g
CH3COOH + NaOH = CH3COONa + H2O
60 40
m(CH3COOH) 0.24g

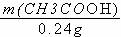
==
m(CH3COOH) =0.36g
则100mL样品中含CH3COOH:0.36g ×10 = 3.6g
所以该食醋合格
14、(1)B (2)解:设反应中生成氧气的质量为x。
2H2O2
 2H2O+O2↑
2H2O+O2↑
2×34 32
17g×5% x
=
x=0.4g
答:略。
13、(1)16;(2)21∶2∶4;(3)77.8%
12、(1)微量 72 : 11 (2)0.05% (3)1
解析:葡萄糖酸锌分子中的碳、氢元素的质量比为:(12×12):(1×22)==72:

11,锌的质量分数== ×100% =0.05%,20kg的儿童每天需要锌的质量为20×0.5mg=10mg,一半即为5mg,所以须口服1支口服液。
11、(1) 7:10:5 (2) l0 (3) 8
解析:分子中原子的个数比即为化学式中右下角的数字之比;35千克的儿童每次用量为60mg,每天2次,5天共服用5×2×60== 600mg,600mg÷75mg=8次。
10、D 解析:葡萄糖、乙酸和尿素中氢元素的质量分数均为 ,所以
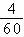
240g混合物中含有氢元素240g× =16g,根据质量守恒定律,也就是水中氢元素的质量,所以生成水的质量为144g。
9、 A 解析:1.8g铝粉和1.8g 铁粉与上述盐酸反应产生氢气的质量不相等,所以天平会发生偏转;而4.2g碳酸镁与上述盐酸反应产生2.2g二氧化碳,天平左盘增加的质量和右盘同为2g,天平平衡;5.6g铁粉和5.6g 锌粉与上述盐酸反应产生的氢气的质量相等,天平平衡;10g碳酸钙反应产生4.4g二氧化碳,天平两盘增加的质量同为5.6g,天平平衡。
A 解析:1.8g铝粉和1.8g 铁粉与上述盐酸反应产生氢气的质量不相等,所以天平会发生偏转;而4.2g碳酸镁与上述盐酸反应产生2.2g二氧化碳,天平左盘增加的质量和右盘同为2g,天平平衡;5.6g铁粉和5.6g 锌粉与上述盐酸反应产生的氢气的质量相等,天平平衡;10g碳酸钙反应产生4.4g二氧化碳,天平两盘增加的质量同为5.6g,天平平衡。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com