
3.昭君出塞和文成公主入藏在当时产生的主要影响是 ( )
A.有利于加强对边疆地区的行政管理
B.促进了汉族与边疆少数民族的经济文化交流
C.使边疆民族政权隶属于中央
D.形成了汉族与少数民族融合的高潮
2.一位同学收集了有关秦始皇加强中央集权措施的资料,其中不符合事实的是 ( )
A.统一度量衡.货币和车轨 B.统一文字
C.颁布通行全国的秦律 D.创立王位世袭制
1.史书所记载的“封建亲戚,以蕃屏周”的现象大规模出现应该在 ( )
A.周武王时期 B.周厉王时期
C.周幽王时期 D.周平王时期
22.甲、乙、丙三同学对三份质量不同的氧化铜与炭粉的混合物样品A、B、C各取一份,
加强热充分反应,测定各样品中氧化铜的量。(碳粉不溶于稀硝酸)
(1)甲取样品A加强热,生成亮红色固体和无色无气味的气体,亮红色固体能全溶解于稀硝酸,生成的无色无气味的气体用澄清石灰水吸收,无气体剩余,生成白色沉淀6.00g,则样品A中氧化铜的质量为 克。
(2)乙取样品B加强热,将所得亮红色固体置于稀硝酸中微热,固体完全溶解,产生2.24L气体(标况),则样品B中氧化铜的质量为 g;若甲同学改为浓硝酸溶解此亮红色固体,完全反应则会生成 L(标况)气体。
(3)丙取样品C加强热,完全反应后将剩余固体置于稀硝酸,所得未溶固体质量比原样品减少了Wg,则样品C中氧化铜的质量为 。(用分数表示)
21.某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2)实验中他们取6.4g铜片和12mL18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:
。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是 (填写字母编号)
A.锌粒 B.石灰石 C.Na2CO3溶液 D.BaCl2溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是 (填写字母编号)。
A.将装置A产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量。
B.将装置A产生的气体缓缓通入足量的硫酸酸化的KMnO4中溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(已折算出标准状况)
②乙学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000ml,取20 ml于锥
形瓶中,滴入甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知:Cu(OH)2开始沉淀的PH约为5),通过测出消耗NaOH溶液的体积来求余酸的物质的量的浓度。
假定反应前后烧瓶中溶液的体积不变,你认为乙学生设计的实验方案能否求得余酸的物质的量浓度 (填“能”或“否”)。其理由是 。
20.黑色固体物质A有以下转化关系,每个方框表示有一种反应物或生成物(反应条件及生成的水略去),其中C、F常温为无色气体,D、E有共同的阳离子。
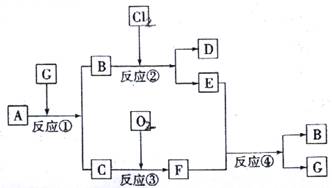
(1)写出B和F的化学式:B ;F 。
(2)写出C的电子式 。
(3)写出反应④的离子方程式 ;写出反应②的离子方程式 。
19.A、B、C、D、E为短周期元素,原子序数依次增大。其中A与E同主族,B的最外层
电子数是次外层电子数的2倍,C的最高价氧化物对应的水化物与其氢化物反应生成一
种盐X。A、B、D、E可组成化合物A2D2、B2A2、E2D2,它们都含有非极性共价健。
(1)C元素在周期表中的位置是 ,写出B的最高价氧化物的结构式 。
(2)X的水溶液显 (填“酸”、“碱”或“中”)性,理由是(用离子方程式表示) 。
(3)A、B、D、E四种元素组成的化合物中原子个数最少的化合物的化学式为
。
(4)火箭推进器中装有液态C2A4和液态的A2D2,它们发生化学反应时生成气态C单质和水蒸气,并放出大量热。已知0.4moI液态C2A4和液态的A2D2完全反应时,放出256.6kJ热量,该反应的热化学方程式为 。
18.下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA,ⅢA族的连接处。请用相应的化学用语回答下列问题:

(1)写出由e形成的两种带有相同核电荷数阴离子的符号: 、 。 (2)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的
离子方程式 。
(3)下左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表
Ar,则其中柱形“8”代表 。(填化学式)

(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物
的名称是 ,序列“2”的氢化物的空间构型为 。
(5)单质a和单质e可以设计为新型燃料电池,电解质为KOH溶液,则单质a在该
燃料电池的 极发生电极反应,电极反应式为 。
17.高铁酸钠(化学式为Na2FeO4)是一种新型净水剂,工业上常通过如下化学反应制取:
Fe2O3+3NaNO3+4NaOH====2Na2FeO4+3NaNO2+2H2O。
(1)反应中,氧化剂为 。
(2)当生成4moLNa2FeO4时,电子转移总数为 moL。
16.用足量的CO还原32.0 g某种氧化物,将生成的气体通入足量澄清石灰水中,得到
60g沉淀,则该氧化物是 ( )
A. FeO B. Fe2O3 C. CuO D. Cu2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com