
22.(12分) A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可形成原子个数比分别为l∶1和1∶2的两种离子化合物X、Y,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题:
(1)X的电子式为: ,C的原子结构示意图为 ,
A、B的气态氢化物更稳定的是 (填化学式).
(2)单质D在CO2中燃烧的化学方程式为 .
(3) 2 mol C的氢氧化物与2 mol B单质在一定条件下恰好完全反应 ,生成一种盐、水及一种气体,写出
,生成一种盐、水及一种气体,写出 该反应的化学方程式 .
该反应的化学方程式 .
(4)常温下,B、C形成的化合物的水溶液中所有离子的物质的量浓度由大到小的顺序为 .
21.(10分)由短周期元素构成的常见离子,它们组成A、B、C、D四种物质,分别溶于水。已知:
①A、C的焰色反应呈黄色
②取A、B溶液,分别加入BaCl2溶液,均生成白色沉淀,再加入稀HNO3,A中沉淀溶解,并产生能使澄清石灰水变浑浊的无色、无臭气体,而B中无变化。
③在D的稀 溶液中加入AgNO3溶液和稀HNO3,有白色沉淀生成。
溶液中加入AgNO3溶液和稀HNO3,有白色沉淀生成。
④在D溶液中滴加C溶液,生成白色沉淀,继续滴入C,白色沉淀消失。
⑤A、B、C溶液的物质的量浓度相等,当A、B溶液以体积比1∶2混合时,生成无色气体;B、C溶液以体积比1∶2混合时,也生成无色气体,此气体能使湿润的红色石蕊试纸变蓝色;如果均以体积比1∶1混合,两者都不生成气体。
(1)写出A、B、C、D的化学式:
A____________,B____________,C____________,D____________。
(2)写出D溶液中不断滴入C溶液的离子方程式:_________________________。
20.近几年一种新型的甜味剂木糖醇悄悄地走入生活,进入人们的视野,因为木糖醇是一种理想的蔗糖代替品,它具有甜味足,溶解性好,防踽齿,适合糖尿病患者的优点。木糖醇是一种白色粉末状的结晶,分子式为C5H12O5,结构简式为CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述中不正确的是( )
A.木糖醇是一种五元醇
B.木糖醇是一种无糖型植物甜味剂
C.木糖醇与葡萄糖、果糖等一样是一种单糖
D.已知木糖醇的溶解度随着温度的升高而增大,说明木糖醇的溶解过程是一个吸热过程
第II卷(非选择题,共50分)
注意:第II卷非选择题请在答题卡内作答。
19.一种从植物 中提取的天然化合物a-damascone,可用于制作“香水”,其结构为:
中提取的天然化合物a-damascone,可用于制作“香水”,其结构为:
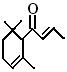 ,有关该化合物的下列说法不正确的是( )
,有关该化合物的下列说法不正确的是( )
A.分子式为C13H20O B.该化合物可发生聚合反应
C.1 mol该化合物完全燃烧消耗19 mol O2
D.与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验
18. 用惰性电极电解+1价汞的硝酸盐溶液时,阴极上得到的产物是单质汞。当阴极消耗2mol该盐的阳离子时,阳极可得到1mol的气体产物,以下叙述正确的是( )
A.阳极上产生氢气 B.电解时要消耗OH--,故溶液的PH值减小
C.阴极的电极反应式:O2+2H2O+4e-=4OH- D.阳极的电极反应式:Hg++e-=Hg
17.醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
16.次氯酸盐最大的用途是漂白和消毒。这类漂白剂氧化能力是以“有效氯”的含量来标志。“有效氯”的含量定义为:从HI中氧化出相同量的I2所需Cl2的质量与指定化合物的质量之比,常以百分数表示。请问纯LiClO的“有效氯”为( )
A、121% B、100% C、89% D、21%
15.下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是( )
A.在硫酸工艺流程中,对尾气中的SO2用过量的氨水吸收的反应
2 NH3·H2O + SO2 = 2NH4+ + SO32- + H2O
B.FeCl2在空气中被氧化 4Fe2+ + O 2 + 2H2O = 4Fe3+ +
4OH-
2 + 2H2O = 4Fe3+ +
4OH-
C.工业上制备漂粉精的反应 Cl2 + 2OH- = Cl- + ClO- + H2O
D.FeBr2(aq) 中通入少量Cl2 2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2 Br2 + 6Cl-
14.质量分数为a%,物质的量浓度为c m ol/L 的KOH溶液,蒸发溶剂,恢复到原来的温度,若质量分数变为2a%,则物质的量浓度变为( )
ol/L 的KOH溶液,蒸发溶剂,恢复到原来的温度,若质量分数变为2a%,则物质的量浓度变为( )
A.等于2c mol/L B.大于2c mol/L
C.小于2c mol/L
 D.在c mol/L-2c mol/L之间
D.在c mol/L-2c mol/L之间
13.已知氯酸钾与蔗糖(C12H22O11)反应的产物为KCl、CO2和H2O,则氧化产物与还原产物的物质的量之比为( )
A.3:2 B.2:3 C.8:1 D.1:8
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com