
7.等差数列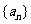 中,
中,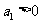 ,
,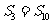 ,则当
,则当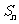 取最大值时,n的值为( )
取最大值时,n的值为( )
A.6 B.7
C.6或7
 D.不存在
D.不存在
6.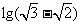 与
与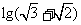 的等差中项为( )
的等差中项为( )
A.0 B.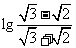 C.
C.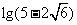 D.1
D.1
5.若lga,lgb,lgc成等差数列,则(  )
)
A b=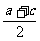
 B b=
B b=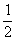 (lga+lgc)
(lga+lgc)
C a,b,c成等比数列 D a,b,c成等差数列
4.已知等差数列共有10项、其中奇数项之和为15,偶数项之和为30,则其公差是( )
A.5 B.4 C. 3 D.2
3.在数列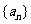 中,
中,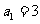 且对于任意大于
且对于任意大于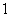 的正整数
的正整数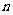 ,点
,点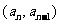 在直线
在直线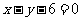 上,则
上,则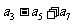 的值为( ).
的值为( ).
A.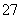 B.
B.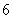 C.
C.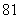 D.
D.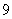
2.在等差数列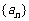 中,
中,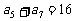 ,
,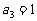 ,则
,则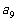 的值是 ( )
的值是 ( )
A.15 B.30 C.-31 D.64
1.在等差数列{an}中,若a4+a6+a8+a10+a12=120,则2 a10-a12的值为( )
A.20 B.22
C. 24
D.28
24
D.28
25.(10分)已知:
① 醛在一定条件下可以两分子加成:
|
|
②A是一种芳香醛。
根据下图所示转化关系填空(所有无机物均已略去)
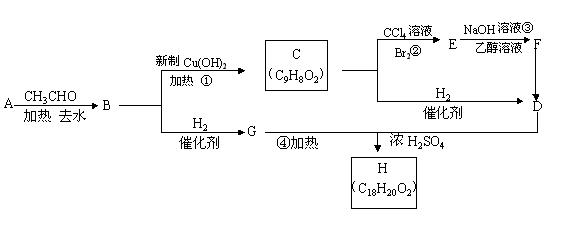
(1)写出B、F的结构简式:
B ;
F 。
(2)写出反应②和③的反应类型:[:]
② ;③ 。
(3)写出G、D反应生成H的化学方程式:___________________________________________________________________。
(4)F若与H2发生加成反应,每摩F最多消耗的H2的物质的量为 mol。
24. (12分)现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
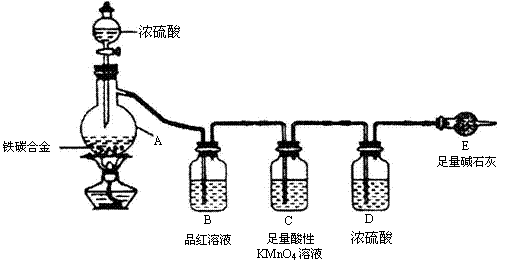
I 测定铁的质量分数:
(1)称量E的质量,并按图示连接装置,是否需要检查装置的气密性________(填“是”或“否”);
(2)装置C的作用________________________________________________;
(3)将a g铁碳合金样品放入A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g,铁碳合金中铁的质量分数为_________(写表达式)
(4)某同学认为:依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,可能的原因是空气中CO2、H2O进入E管使b增大。请问该同学的观点是否正确___________(填“是”或“否”)。
Ⅱ 探究浓硫酸的某些性质:
(5)未点燃酒精灯前,A、B 均无明显现象,其原因是:__________________;点燃酒精灯一段时间后,A、B 中可观察到明显的现象,B中的现象是_________________;A中发生反应的化学方程式(只写一个)__ ________________________ 。
________________________ 。
23.(6分)氯、溴、碘同属于周期表中的VII A族,在上个世纪,人们很早就制得高碘酸及其盐,但得不到含+7价溴的化合物,1968年,化学家用发现不久的XeF2和KBrO3首先制得纯净的KBrO4晶体。
(1)高碘酸盐(IO65-)能在酸性条件下将Mn2+氧化为MnO4-(本身被还原成I03-),其反应平稳而迅速,写出离子反应方程式
。
(2)在25℃,已知pH=2的高碘 酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol·L-1的碘酸或高锰酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性。则高碘酸是 ;高锰酸是
酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol·L-1的碘酸或高锰酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性。则高碘酸是 ;高锰酸是
(填“强酸”或“弱酸”)。
(3)写出XeF2和含KOH、KBrO3的水溶液反应得到KBrO4的离子方程式: _________________________________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com