
4.一年好景君须记,最是橙黄橘绿时。自然界的绚丽色彩是艺术的重要源泉,下列有关色彩的叙述错误的是
A.一束灿烂的阳光照到三棱镜上,可以观察到七色光
B.印象主义流派画家根据光色原理对绘画色彩进行了大胆革新
C.护士服由原来的白色改为粉红色是因为粉红色为暖色,给人以温暖、温馨的感觉
D.用颜料三原色可以调配出绝大多数色彩,同样其他颜色也能调配出三原色
3.“别愁逢夏果,归与入秋蝉”,从夏天到秋天知了的叫声一直陪伴着我们。用心聆听,知了的叫声是有节奏的,下面节奏符合其叫声规律的是
2.某校高三举行“金秋十月”作文大赛,要求参赛者以电子稿件WORD的形式上交作品。右图是李华制作作品的一页,若要对其进一步编辑,下列操作不能实现的是
A.右击图片→设置图片格式→版式→嵌入型
B.点击“文件”菜单→页面设置→纸张→A4
C.在“格式”→“分栏”中选择栏数为“两栏”
D.点击“视图”菜单→全选→左击全选内容→字体
1.春华秋实,“秋”是成熟的季节,是收获的季节。下列有关“秋”的描写错误的是
A.蓝蓝的天,白白的云,大雁成群往南行
B.葡萄紫、柿子红,一串一串像灯笼
 C.菊花黄,麦花香,天高云淡天气爽
C.菊花黄,麦花香,天高云淡天气爽
D.缤纷的落叶,五彩的菊,五彩缤纷是秋季
23.(8分)向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3 Fe(NO3)3+NO↑+H2O
Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段反应的离子方程式. ,
。
(2)加入铁粉的物质的量和溶液中铁元素存在的形式.
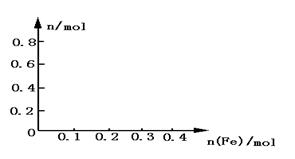 (3)在图中分别画出溶液中Fe2+、
(3)在图中分别画出溶液中Fe2+、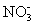 的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中Fe2+、
的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中Fe2+、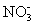 的物质的量).
的物质的量).
22.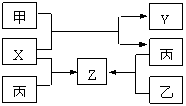 (10分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下转化关系:
(10分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下转化关系:
(1)若甲是短周期金属单质,乙、丙是短周期非金属单质。X、Y、Z中只有一种是离子化合物,试推断:
①含有丙元素的化合物是 (填X、Y、Z)
②X与甲反应的化学方程式 。
(2)若甲是具有氧化性的黄绿色气体单质,丙通常状况下是深红棕色液体,X、Y、Z含有同种元素形成的阳离子,但Y和Z的阳离子价态相同,X和Y的阳离子价态不同,试推断:
①写出乙、丙的化学式 。
②写出X与足量的甲在溶液中完全反应的离子方程式
。
21.(8分)某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):
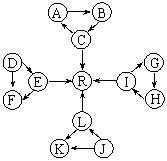 已知:①图中每个小三角形的三种物质中至少含有一种相同元素,K与L含有完全相同的元素。②D、J为固体单质,R为气体单质,其余物质为常见化合物。③A能使品红溶液褪色,也能使澄清石灰水变浑浊。④E为淡黄色化合物,E与C或L反应都能生成R。⑤I为金属氧化物,在F或C溶液中都能反应;G和L反应生成难溶物H,H具有较强的吸附性。
已知:①图中每个小三角形的三种物质中至少含有一种相同元素,K与L含有完全相同的元素。②D、J为固体单质,R为气体单质,其余物质为常见化合物。③A能使品红溶液褪色,也能使澄清石灰水变浑浊。④E为淡黄色化合物,E与C或L反应都能生成R。⑤I为金属氧化物,在F或C溶液中都能反应;G和L反应生成难溶物H,H具有较强的吸附性。
根据以上信息,回答下列问题:
(1)写出下列反应的化学方程式:
①C→A:_____________________________________________________________
②L→R:______________________________________________________________。
(2)写出下列反应的离子方程式:
①E→F:______________________________________________________________。
②I→G:______________________________________________________________。
20.(12分)虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功。直到1986年,化学家Karl Christe首次用化学方法制得了F2。他提出的三步反应如下(反应①、②里氟元素化合价不变):
① KMnO4 + KF + H2O2 + HF → K2Mn F6 + ____________ + H2O
② SbCl5 + HF → SbF5 + ____________
③ 2K2MnF6 + 4SbF5 === 4KSbF6 + 2MnF3 + F2↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为______________,为什么填这一物质,试用氧化还原反应理论解释___________________________________________________;
(2)完成反应② ___________________________________________________。
(3)反应③中的氧化剂为______________,被氧化的元素为_______________,
若有1mol K2MnF6参加反应,将会有 mol电子发生转移。
19.(12分)印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5 mol·L-1、FeCl2 3.0 mol·L-1、FeCl3 1.0 mol·L-1、HCl 3.0 mol·L-1。取废腐蚀液200 mL按如下流程在实验室进行实验:
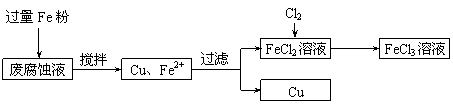

回答下列问题:
(1)在上述流程中,“过滤”用到的玻璃仪器:普通漏斗、玻璃棒、 ;用上述方法获得的铜粉中含有杂质,除杂所需试剂是__________(填化学式)。
(2)实验室可用浓盐酸和固体KMnO4直接反应制备Cl2。此反应的离子方程式为___________________________________________________________。
此反应中体现了盐酸的______________________________性质。
利用图1制备Cl2并通入到FeCl2溶液中获得FeCl3溶液。
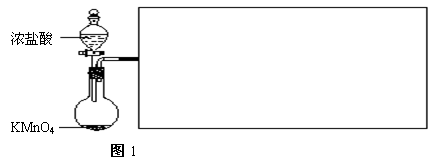
 请从图2中挑选所需的仪器,完成图1装置简图(可添加必要的塞子、玻璃导管、胶皮管。不画固定装置),并标明容器中所装试剂名称。
请从图2中挑选所需的仪器,完成图1装置简图(可添加必要的塞子、玻璃导管、胶皮管。不画固定装置),并标明容器中所装试剂名称。
(3)按上述流程操作,需称取Fe粉的质量应不少于_____________g,
需通入Cl2的物质的量不少于_______________mol。
18.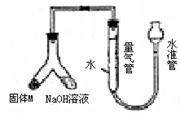 (10分)某课外兴趣小组为探究某种铝合金(合金元素为Mg Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计右图装置进行实验。
(10分)某课外兴趣小组为探究某种铝合金(合金元素为Mg Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计右图装置进行实验。
(1)如何检验该装置的气密性
。
(2)合金样品固体M与氢氧化钠溶液反应的离子方程
式 。
(3)倾斜左边装置使氢氧化钠溶液(足量)与ag合金粉末(固体M)充分反应,待反应停止后,进入量气管气体的体积为VmL(已折算成标准状况)。若量气管最大量程为50mL.,则固体M中铝的质量(mA1)范围为 。
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积 (填“>”“<”“=”)VmL。
(5)若a=38mg,V=44.8mL(标准状况),请通过计算说明该合金是否符合国家标准(不写计算过程) (填“符合”或“不符合”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com