
27.(6分)平衡常数表明了某可逆反应在给定温度下正向进行的程度,对同一类型的反应,平衡常数越大,表明反应进行的程度越大。
H2CO3
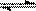 HCO3- + H+ Ka1(H2CO3)= 4.45×10-7
HCO3- + H+ Ka1(H2CO3)= 4.45×10-7
HCO3- 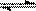 CO32- +
H+ Ka2(HCO3-) = 5.61×10-11
CO32- +
H+ Ka2(HCO3-) = 5.61×10-11
HClO 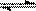 H+ + ClO-
Ka(HClO)= 2.95×10-8
H+ + ClO-
Ka(HClO)= 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量氯气通到过量的碳酸溶液中 ;
②氯气和碳酸钠按照1:1的比例恰好反应 ;
③将过量氯气通到少量的碳酸钠溶液中 。
26.室温下,有①Na2CO3溶液②CH3COONa溶液③NaOH溶液各25ml,下列说法正确的是
( )
A.物质的量浓度均为0.1mol/L,3种溶液PH的大小顺序是③>②>①
B.物质的量浓度均为0.1mol/L,将3种溶液稀释相同倍数,pH变化最大的是②
C.物质的量浓度均为0.1mol/L,分别加入25ml0.1mol/L盐酸后,pH最大的是①
D.pH均为9时,3种溶液的物质的量浓度的大小顺序是③>①>②
25..用某种仪器量一液体体积时,平视读数为V1mL,仰视读数为V2mL,俯视读数为V3mL,若V3>V1>V2,则所使用仪器可能是
A.容量瓶 B.量筒 C.碱式滴定管 D.以上仪器均可
24.应用元素周期律,判断下列语句正确的组合是 ( )
①碱金属单质的熔点随原子序数的增大而降低
②砹(At)是ⅦA族,其氢化物的稳定性大于HCl
③硒(Se)的最高价氧化物对应的水化物的酸性比硫酸弱
④第2周期非金属的气态氢化物溶于水后,水溶液均为酸性
⑤铊(Tl)与铝同主族,其单质既能与盐酸反应又能与NaOH溶液反应
⑥第3周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱
A.①③④ B.①③⑥ C.③④⑤ D.②④⑥
23.把足量的铁粉投入到H2SO4和CuSO4的混合溶液中,充分反应后,残余固体与原来加入的铁粉质量相等,则原溶液中H+ 与SO42-的物质的量浓度之比为 ( )
A.1∶4 B.2∶7 C.1∶2 D.8∶1
22.已知一定温度下合成氨反应:
N2 +3 H2 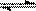 2NH3 (每生成2 mol NH3放出92.4 kJ的热量),在恒温恒容的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是 ( )
2NH3 (每生成2 mol NH3放出92.4 kJ的热量),在恒温恒容的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是 ( )
A.Q2 = 2 Q1 B.Q1 < 0.5 Q2
C.Q1 < Q2 = 184.8 kJ D.Q1 = Q2 < 92.4 kJ
21.常温时,下列四种溶液,pH最小的是 ( )
A.0.02 mol/L的醋酸与0.02 mol/L的氢氧化钠溶液等体积的混合溶液
B.0.03 mol/L的醋酸与0.01 mol/L的氢氧化钠溶液等体积的混合溶液
C.pH=2的盐酸与pH=12的氢氧化钠溶液等体积的混合溶液
D. 0.01 mol/L的醋酸溶液
20.物质的量浓度相同的下列溶液中,c(CO32-)浓度由大到小的顺序排列正确的是 ( )
①H2CO3 ; ②Na2CO3 ; ③NaHCO3 ; ④NH4HCO3 ;
⑤(NH4)2CO3
A.②>⑤>③>④>①
B.⑤>②>③>④>①
C.②>⑤>④>③>①
D.②>③>⑤>①>④
19. 将0.2 mol/L HCN溶液和0.1 mol/L的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是 ( )
A.c(HCN)<c(CN-) B.c(Na+)>c(CN-)
C.c(HCN)-c(CN-)=c(OH-) D.c(HCN)+c(CN-)= c(Na+)
18.用铅蓄电池电解苦卤水(含C1-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中正确的是 ( )
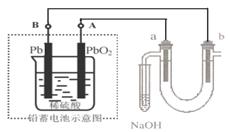 A.铅蓄电池负极的反应式为:Pb -2e- === Pb2+
A.铅蓄电池负极的反应式为:Pb -2e- === Pb2+
B.铅蓄电池放电时,B极质量减轻,A极质量增加
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a 电极首先放电的是Br-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com