
25、(1) ①_____________________________。
②_____________________________________________。
(2) __________________________________________
(3)_________________ , ______________________________________________;
______(填“>”、“=”或“<”)2 L,原因是___________________________________。
24.
(1)C的电子式 。(2)A的化学式 。
(3)D+E→C+G的方程式 。
(4)H+H2O2→I的离子反应方程式 。
(5) 。
23.(1)①______________________________________ ;
②___________________________________________________________。
(2) 。
(3) 。 。
(4)ΔH2= 。
27.NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:
Na2CO3+nH2O=Na2CO3·nH2O(n为平均值,n≤10)。取没有妥善保管的NaHCO3样品9.16g,溶于水制成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表。(溶于水的CO2不计)
|
盐酸的体积(mL) |
4 |
8 |
15 |
20 |
50 |
120 |
150 |
|
生成CO2的体积(mL) |
0 |
0 |
112 |
224 |
896 |
2240 |
2240 |
求:(1)稀盐酸的物质的量浓度
(2)样品中的成分及成分的物质的量
金华一中2009学年第一学期高三期中考试
化学答题试题
26.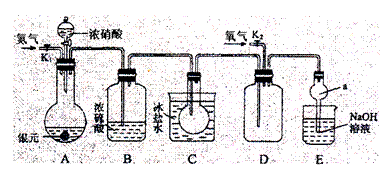 下图为某实验者设计的验证银圆(银和铜的合金)完全溶解于一定量的浓硝酸后生成NO2气体中含有NO的实验装置图。常温时,NO2与N2O4同时存在;在低于0℃时,几乎只有无色的N2O4的晶体存在。
下图为某实验者设计的验证银圆(银和铜的合金)完全溶解于一定量的浓硝酸后生成NO2气体中含有NO的实验装置图。常温时,NO2与N2O4同时存在;在低于0℃时,几乎只有无色的N2O4的晶体存在。
(1)反应前先打开A中的活塞K1,持续通一段时间N2,其理由是
(2)若装置中缺B,其后果是 。
(3)反应结束后,打开D中的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因是 。
(4)C装置的作用是 ; E中a仪器所起的作用是 。
25、食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
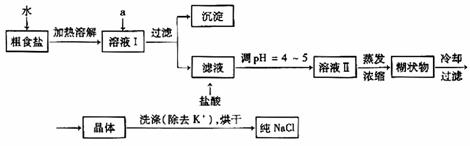
 提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为_________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为__________________。
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用 仪器除药匙、玻璃棒外还有_______________(填仪器名称)。
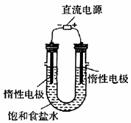
(3) 目前,氯碱工业采用_______________电解槽电解饱和食盐水, 其化学方程式______________________________________;
我们改用右图装置进行电解饱和食盐水,若收集的H2为2 L,则同样条件下收集的Cl2______(填“>”、“=”或“<”)2 L,原因是__________。
24.化合物A是一种重要的光化学试剂,属不 含结晶水的复盐。A-H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)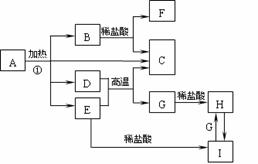
已知:A中含二种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3:1:3。阴离子中各元素的质量分数与C相同且式量是C的2倍。C、D都为气体且含有元素种类相同,C能使澄清石灰水变浑,E是一种红棕色的颜料,F的焰色反应呈紫色,I能使苯酚溶液显紫色。回答下列问题:
(1)C的电子式 。
(2)A的化学式 。
(3)D+E→C+G的方程式 。
(4)H+H2O2→I的离子反应方程式 。
(5)在A的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,而在A的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是 。
23.(1)膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂,但膦在水中的溶解度远小于氨,微溶于水。某反应体系中存在下列物质:Cu、H2SO4、CuSO4、PH3、H3PO4、H2O。回答下列问题:
①上述反应体系中化学反应方程式为______________________________________ ;
②膦(PH3)在水中的溶解度远小于氨的原因是___________________________________。
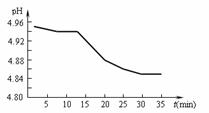 (2)SO2的排放是造成酸雨的主要因素。某地区酸雨 pH随时间的变化如下图所示。请用化学方程式表示该地区酸雨pH随时间增加而减小的原因:
(2)SO2的排放是造成酸雨的主要因素。某地区酸雨 pH随时间的变化如下图所示。请用化学方程式表示该地区酸雨pH随时间增加而减小的原因:
。
(3)生活污水中含大量细小的悬浮物,可加入某些物质使之聚集成较大的颗粒而沉淀。请你举一种常见的能使生活污水中悬浮物聚沉的物质,其化学式为 。若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
(4)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g)
ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2= 。
22.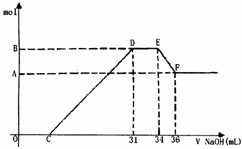 硝酸发生氧化还原反应的时候, 一般硝酸浓度越稀,对应的还原产物中氮的化合价越低。现有一定量的铝铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4mol /L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列说法中不正确的是
硝酸发生氧化还原反应的时候, 一般硝酸浓度越稀,对应的还原产物中氮的化合价越低。现有一定量的铝铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4mol /L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列说法中不正确的是
A.合金与硝酸反应时硝酸过量 B.合金中铝的物质的量为0.008mol
C.合金中金属的物质的量共为0.032mol D.无法求出C点的值
21.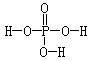 磷酸的结构式如右图所示 ,磷酸分子与磷酸分子的羟基之间可以脱去水。三个磷酸分子可以脱去两个水分子生成三聚磷酸。含磷洗衣粉中含有三聚磷酸的钠盐(正盐),则该钠盐的化学式及1mol此钠盐中P-O单键的物质的量分别是:
磷酸的结构式如右图所示 ,磷酸分子与磷酸分子的羟基之间可以脱去水。三个磷酸分子可以脱去两个水分子生成三聚磷酸。含磷洗衣粉中含有三聚磷酸的钠盐(正盐),则该钠盐的化学式及1mol此钠盐中P-O单键的物质的量分别是:
A.Na5P3O12 12mol B.Na3H2P3O10 9mol
C.Na5P3O10 9mol D.Na2H3P3O10 12mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com