
9.(安徽师大附中2009届高三上学期期中考试)某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是_________。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有的离子是___________,有关的离子反应式为______________。
(3)取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有_______________。
(4)原溶液中可能大量存在的阴离子是下列A-D中的(填序号)_________。
A.Cl- B.NO3- C.CO32- D.OH-
[解析](1)由题意无色透明溶液知,原溶液一定不含Cu2+;(2)依据题意可知,原溶液中肯定有的离子是Ag+;(3)加入过量NaOH溶液出现白色沉淀,说明原溶液中肯定存在的离子Mg2+;(4)结合原溶液中含有的阳离子,则原溶液中可能大量存在的阴离子为 。
。
[答案](1)Cu2+;(2)Cl-;Ag++ =AgCl↓;(3)Mg2+ ;(4)B。
=AgCl↓;(3)Mg2+ ;(4)B。
8.
(海南三亚一中2009届高三年级第三次月考)
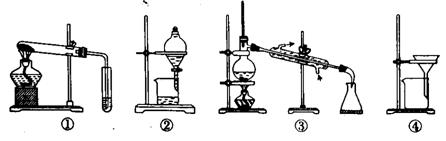 下列叙述中不正确的是 (
)
下列叙述中不正确的是 (
)

A.可用装置①鉴别碳酸钠和碳酸氢钠
B.可用装置②分离汽油和水的混合物
 C.可用装置③从海水中蒸馏得到淡水
C.可用装置③从海水中蒸馏得到淡水
D.可用装置④把胶体粒子从分散系中分离出来
[解析]A项中碳酸钠和碳酸氢钠的热稳定性不同,可用加热的方法鉴别;B项中汽油和水互不相溶,可用分液的方法分离;C项中海水蒸馏可以得到淡水,使用蒸馏的装置;D项中把胶体粒子从分散系中分离出来,应用渗析的方法,故D项错误。
[答案]D
7. (福建省厦门第一中学2008-2009学年度第一学期期中考试)香烟烟雾中含有CO、CO2、SO2、H2O等气体,用①无水CuSO4 ②澄清石灰水 ③红热CuO ④碱石灰 ⑤品红溶液 ⑥酸性KMnO4溶液等药品可将其一一检出,检测时香烟烟雾通入药品的正确顺序是
A.①⑤②④②③②④① B.①⑤⑥⑤②④②③②
 C.③④②⑥⑤①②
D.②⑤①④③⑥②
C.③④②⑥⑤①②
D.②⑤①④③⑥②
[解析]由于检验CO、CO2、SO2需要通过溶液,这样应先检验H2O的存在,即应先用①无水CuSO4检验H2O的存在,为了检验CO2则SO2干扰,应在检验CO2前先检验SO2并除尽SO2,验证CO应将其转化为CO2检验,但在检验CO前应再先检验CO2后并将其除尽,鉴于这样的原则,为将香烟烟雾中含有CO、CO2、SO2、H2O等气体一一检出,检测时香烟烟雾通入药品的正确顺序应为B项。
[答案]B
6. (福建省漳州市芗城中学2009届高三一轮复习单元测试)为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是
A.Na2SO3溶液(BaCl2) B.FeCl2溶液(KSCN)
C.KI(淀粉溶液) D.HCHO溶液(石蕊试液)
[解析]A项中缺少稀盐酸,不能达到目的;B项加入KSCN溶液后,若溶液变血红色,则FeCl2溶液氧化变质FeCl3溶液;C项加入淀粉溶液若变蓝,则KI氧化变质成I2;D项加入石蕊试液若变红,则HCHO溶液变质成HCOOH。
[答案]A
5. (安徽省六安市2008---2009年度高三年级第一次调研试)下列除去杂质的方法中,正确的是
A.除去铜粉中混有的铁:加足量稀硝酸,过滤
B.除去N2中少量的CO:通过足量灼热的CuO粉末

 C.除去KCl溶液中的少量CaCl2:加适量Na2CO3溶液,过滤
C.除去KCl溶液中的少量CaCl2:加适量Na2CO3溶液,过滤
D.除去CO2中的少量的HCl:通过足量的饱和碳酸氢钠溶液
[解析]A项中铜粉也能与稀硝酸反应;B项中消耗CO,又产生了CO2;C项中除去了Ca2+,又混入了Na+;D项HCl与饱和碳酸氢钠溶液反应产生CO2,且CO2又不与饱和碳酸氢钠溶液反应,故该项正确。
[答案]D
4. (安徽省岳西中学2009届高三第二次质量检测)对于某些离子的检验及结论一定正确的是
(安徽省岳西中学2009届高三第二次质量检测)对于某些离子的检验及结论一定正确的是
A.通入Cl2后,溶液变为黄色,加淀粉液后溶液变蓝,则原溶液中一定有
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有
C.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
[解析]A项使淀粉变蓝的物质是I2,而通入Cl2后,溶液变为黄色,则说明原溶液中不是I2,而是 ;B项中Ag+干扰;C项中
;B项中Ag+干扰;C项中 干扰;D项中Ca2+干扰。
干扰;D项中Ca2+干扰。
[答案]A
3.
(安徽师大附中2009届高三上学期期中考试)有一瓶无色溶液,可能含有K+、Al3+、Mg2+、 、
、 、
、 、
、 、
、 离子中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的
离子中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的
A.肯定有Al3+、Mg2+、 、
、 B.肯定有Al3+、Mg2+、
B.肯定有Al3+、Mg2+、
C.肯定有K+、 、
、 D.肯定有Al3+、Mg2+、
D.肯定有Al3+、Mg2+、
[解析]由①再加入足量的NaOH溶液后白色沉淀部分溶解知,溶液中一定含有Al3+、Mg2+,再有②知,溶液中一定含有 。
。
[答案]D
2.
 (安徽泗县一中2008-2009学年第一学期高三第二次考试)有A、B、C、D、E、F 6瓶不同物质的溶液,它们各是NH3·H2O、Na2CO3、MgSO4、NaHCO3、HNO3和BaCl2溶液中的一种。为了鉴别它们,各取少量溶液进行两两混合,实验结果如表所示。表中“↓”表示生成沉淀,“↑”表示生成气体,“-”表示观察不到明显现象,空格表示实验未做。试推断其中F是
(安徽泗县一中2008-2009学年第一学期高三第二次考试)有A、B、C、D、E、F 6瓶不同物质的溶液,它们各是NH3·H2O、Na2CO3、MgSO4、NaHCO3、HNO3和BaCl2溶液中的一种。为了鉴别它们,各取少量溶液进行两两混合,实验结果如表所示。表中“↓”表示生成沉淀,“↑”表示生成气体,“-”表示观察不到明显现象,空格表示实验未做。试推断其中F是
A.NaHCO3溶液 B.BaCl2溶液
C.MgSO4溶液 D.Na2CO3溶液
[解析]通过两两混合实验,可观察的现象及结合表所示得到:只产生一种沉淀的是B为NH3·H2O,产生两种沉淀和一种气体的是A为Na2CO3,产生三种沉淀的是D为MgSO4,与A产生气体的是E为HNO3,与A和D产生两种沉淀的是C为BaCl2,没有明显现象的是F为NaHCO3。
[答案]A
1. (安徽泗县一中2008-2009学年第一学期高三第二次考试)下列根据实验现象所作出的结论中一定正确的是
A.无色试液中滴加酚酞试液,溶液变红,结论:该试液一定呈现碱性
B.某溶液加入盐酸,放出不能使品红溶液退色的气体,结论:试液中含有
C.无色试液焰色反应呈黄色,结论:试液中一定含有Na+、没有K+
D.无色试液加入碳酸钠溶液产生白色沉淀,结论:试液中溶质为钙盐或钡盐
[解析]A项中溶液滴加酚酞试液变红,则依据指示剂的现象知:该试液一定呈现碱性;B项溶液中可能含有 干扰;C项钾元素的焰色为紫色,但必需通过蓝色的钴玻璃滤去黄光,从而说明不通过蓝色的钴玻璃,则会观察的是黄光,故无色试液焰色反应呈黄色,则试液中一定含有Na+、不能确定是否含有K+;D项中能与碳酸钠溶液产生白色沉淀,不仅是钙盐或钡盐,还有铝盐等。
干扰;C项钾元素的焰色为紫色,但必需通过蓝色的钴玻璃滤去黄光,从而说明不通过蓝色的钴玻璃,则会观察的是黄光,故无色试液焰色反应呈黄色,则试液中一定含有Na+、不能确定是否含有K+;D项中能与碳酸钠溶液产生白色沉淀,不仅是钙盐或钡盐,还有铝盐等。
[答案]A
17. (2009天津卷9)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列;从海水中提取食盐和溴的过程如下:
(2009天津卷9)海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列;从海水中提取食盐和溴的过程如下:
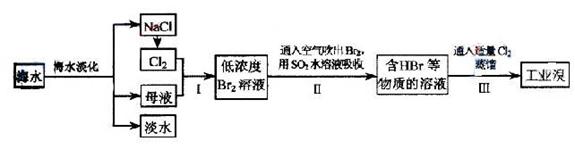
(1)请列举海水淡化的两种方法: 、 。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、 、 、或H2、 。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为 。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为 ,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是 。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图。
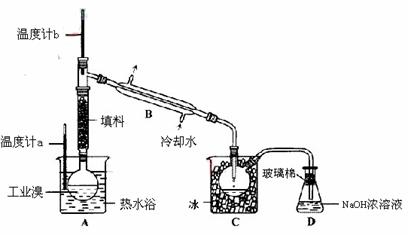
请你参与分析讨论:
 ①图中仪器B的名称: 。
①图中仪器B的名称: 。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
④C中液体产生颜色为 。为除物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是 。
[解析]本题考查海水中提取溴的实验。电解NaCl溶液的方程式为:2NaCl + 2H2O  2NaOH + H2↑+ Cl2↑,其中Cl2有可能与NaOH会生成NaClO。步骤I中的Br2的浓度很小,多次用SO2反复吸收,最终用Cl2处理,则可获得大量的工业溴。溴具有强氧化性可以氧化SO2,生成H2SO4,因此要注意酸对设备的腐蚀问题。溴具有腐蚀性,可以腐蚀橡胶。蒸馏的目的,就是通过沸点不同而提纯Br2,所以要通过温度计控制好Br2沸腾的温度,尽可能使Br2纯净。
2NaOH + H2↑+ Cl2↑,其中Cl2有可能与NaOH会生成NaClO。步骤I中的Br2的浓度很小,多次用SO2反复吸收,最终用Cl2处理,则可获得大量的工业溴。溴具有强氧化性可以氧化SO2,生成H2SO4,因此要注意酸对设备的腐蚀问题。溴具有腐蚀性,可以腐蚀橡胶。蒸馏的目的,就是通过沸点不同而提纯Br2,所以要通过温度计控制好Br2沸腾的温度,尽可能使Br2纯净。
[答案](1)蒸馏法 电渗析法 离子交换法 (或其他合理答案中的任意两种)
(2)Cl2 NaOH NaClO (3)富集溴元素
(4)Br2+SO2+2H2O 4H++ +2
+2 强酸对设备的严重腐蚀
强酸对设备的严重腐蚀
(5)①冷凝管 ②Br2腐蚀橡胶 ③控制温度计b的温度,并收集59℃时的馏分
④深红棕色 分液(或蒸馏)
[考点分析]本题注重理论和生产生活的实际结合,起点高,但题目平易近人。
[专题突破]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com