
1.(09江苏省口岸中学高三第二次月考)根据下列实验现象,所得结论正确的是 ( )
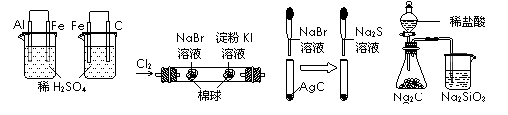 A
B
C
D
A
B
C
D
|
实验 |
 实验现象 实验现象 |
结论 |
|
A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
|
B |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
|
C |
白色固体先变为淡黄色,后变为黑色 |
 溶解性AgCl>AgBr>Ag2S 溶解性AgCl>AgBr>Ag2S |
|
D |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
(1)常用的物理方法--根据物质物理性质上的差异选择分离与提纯方法。有过滤、蒸发结晶、降温结晶、蒸馏、分馏、萃取、分液、渗析、升华等方法。
(2)常用的化学方法
吸收法--常用于气体的净化和干燥,可根据被提纯气体中所含杂质气体的性质,选择适当的固体或溶液作为吸收剂。如Cl2中混有的HCl气体可通过饱和食盐水除去。常用装置是洗气瓶或干燥管(U形管)。
沉淀法--在被提纯的物质中加入适量试剂使其与杂质反应,生成沉淀过滤除去。如硝酸钾中含有的少量硝酸钡,可用适量的硫酸钾除去。
气体法--根据物质中所含杂质的性质加入合适的试剂,让杂质转化为气体除去。如KCl中混有的少量K2CO3,可加适量盐酸除去。
转化法--利用化学反应,加入适当的试剂或采用某种条件(如加热),使物质中的杂质转化为被提纯物质,以正盐、酸式盐间的转化最为常见。如:NaHCO3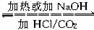 Na2CO3。
Na2CO3。
 溶解法--对于固体试剂可选择适当的物质将杂质溶解,然后过滤除去,以杂质为两性物质常见。如Mg(OH)2中混有Al(OH)3,可用过量NaOH溶液除去,然后洗涤Mg(OH)2即可。
溶解法--对于固体试剂可选择适当的物质将杂质溶解,然后过滤除去,以杂质为两性物质常见。如Mg(OH)2中混有Al(OH)3,可用过量NaOH溶液除去,然后洗涤Mg(OH)2即可。
(3)综合法
综合法是指综合运用物理方法和化学方法将物质加以分离或提纯。如分离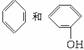 的
的
混合物:
常见物质的检验方法,一方面是根据物质的物理性质(如颜色、溶解性、溶解热效应等)直接检验,另一方面是根据物质化学性质,使被检验物质与加入的试剂作用,产生某种特殊现象(如:生成气体、沉淀,产生特殊颜色等),从而确定该物质的存在。
 (1)离子的检验。检验的原理是依据离子的特征反应现象如呈现特殊颜色变化、生成沉淀、生成气体等。十种常见离子的检验方法是:K+、Na+用焰色反应;
(1)离子的检验。检验的原理是依据离子的特征反应现象如呈现特殊颜色变化、生成沉淀、生成气体等。十种常见离子的检验方法是:K+、Na+用焰色反应; 用浓氢氧化钠溶液、加热产生的气体检验;Fe3+用硫氰化钾溶液检验;Al3+用氢氧化钠溶液检验;
用浓氢氧化钠溶液、加热产生的气体检验;Fe3+用硫氰化钾溶液检验;Al3+用氢氧化钠溶液检验; 、
、 、
、 用硝酸银溶液和稀硝酸检验;
用硝酸银溶液和稀硝酸检验; 用盐酸和澄清石灰水检验;
用盐酸和澄清石灰水检验; 用Ba(NO3)2溶液(或BaCl2溶液)和稀硝酸(或稀盐酸)检验。
用Ba(NO3)2溶液(或BaCl2溶液)和稀硝酸(或稀盐酸)检验。
 (2)气体的检验。检验的根据是由气体的特征性质(化学和物理的)所表现的现象。但是注意:有些现象是某几种气体所共有的,如二氧化碳与二氧化硫都能使澄清的石灰水变浑浊,不少可燃性气体(如氢气、一氧化碳、甲烷等)的燃烧,其火焰都呈淡蓝色,当它们混有一定量空气时,点燃都会爆鸣;溴蒸气、氯气、二氧化氮都能使碘化钾淀粉试纸变蓝等等。因此遇到这些情况,不要过早下结论,而要综合考虑性质和现象。
(2)气体的检验。检验的根据是由气体的特征性质(化学和物理的)所表现的现象。但是注意:有些现象是某几种气体所共有的,如二氧化碳与二氧化硫都能使澄清的石灰水变浑浊,不少可燃性气体(如氢气、一氧化碳、甲烷等)的燃烧,其火焰都呈淡蓝色,当它们混有一定量空气时,点燃都会爆鸣;溴蒸气、氯气、二氧化氮都能使碘化钾淀粉试纸变蓝等等。因此遇到这些情况,不要过早下结论,而要综合考虑性质和现象。
(3)有机物的检验。常用的试剂有:
①高锰酸钾酸性溶液:烯烃、炔烃、苯的同系物、醇、酚、醛、甲酸、甲酸酯、甲酸盐、葡萄糖、麦芽糖等均可使高锰酸钾酸性溶液褪色。
②溴水:烯烃、炔烃、酚、醛、甲酸、甲酸酯、甲酸盐、葡萄糖均可使溴水褪色(加成或氧化反应)。
③银氨溶液:凡含有-CHO的有机物如醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖均可发生银镜反应。
④新制的Cu(OH)2碱性悬浊液:常温下,多羟基的物质如甘油、乙二醇、葡萄糖都能溶解新制的Cu(OH)2?得绛蓝色溶液,羧酸与Cu(OH)2发生中和反应得蓝色溶液。含-CHO的物质与新制Cu(OH)2?碱性悬浊液加热有砖红色 Cu2O沉淀生成?。
⑤FeCl3溶液:与苯酚反应形成紫色溶液。
(1)固态物质的检验

(2)无色溶液的检验


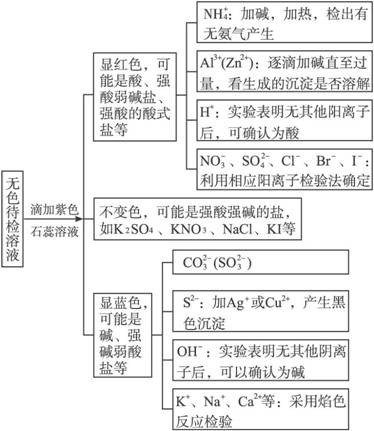
(3)气态物质的检验
由于气体贮存困难,使用时易扩散,故检验中要尽可能使用物理性质加以检验,即使使用化学方法,尽可能多用试纸。可按下列顺序检验:

5.(安徽怀远二中2009届高三上学期第四次月考,化学,21)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、 、Mg2+、Ba2+、
、Mg2+、Ba2+、 、
、 、
、 。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
|
实验序号 |
实验内容 |
实验结果 |
|
1 |
加AgNO3溶液 |
有白色沉淀生成 |
|
2 |
加足量NaOH溶液并加热 |
收集到气体1.12L(已折算成标准 状况下的体积) |
|
3 |
加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6. 27g,第二次 称量读数为2.33g |
试回答下列问题:
(1)根据实验1对C1-是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”);根据实验1-3判断混合物中一定不存在的离子是 。
 (2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
|
阴离子符号 |
物质的量浓度(mol·L-1) |
|
|
|
|
|
 |
(3)试确定K+是否存在? ,判断的理由是
[解析](1)因溶液中可能含有 、
、 的干扰,所以不能确定原溶液中是否含有
的干扰,所以不能确定原溶液中是否含有 ;由实验3可知,溶液中一定含有
;由实验3可知,溶液中一定含有 、
、 ,则由此可知,原溶液中一定不含Mg2+、Ba2+;(2)由实验3可知,BaSO4的质量为2.33g,则
,则由此可知,原溶液中一定不含Mg2+、Ba2+;(2)由实验3可知,BaSO4的质量为2.33g,则 的物质的量为0.01mol,浓度是0.1mol·L-1;BaCO3的质量为6.27g-2.33g=3.94g,
的物质的量为0.01mol,浓度是0.1mol·L-1;BaCO3的质量为6.27g-2.33g=3.94g,  的物质的量为0.02mol,浓度是0.2mol·L-1;(3)由实验2、3可知,溶液中一定含有NH4+、
的物质的量为0.02mol,浓度是0.2mol·L-1;(3)由实验2、3可知,溶液中一定含有NH4+、 和
和 ,经计算,NH4+的物质的量为0.05mol
,经计算,NH4+的物质的量为0.05mol 、
、 的物质的量分别为0.02mol和0.01mol,根据电荷守恒,得K+一定存在。
的物质的量分别为0.02mol和0.01mol,根据电荷守恒,得K+一定存在。
[答案](1)不能确定;Ba2+、Mg2+;(2)
|
阴离子符号 |
物质的量浓度(mol·L-1) |
 |
0.1 |
 |
0.2 |
(3)存在:溶液中肯定存在离子是NH4+、 和
和 。经计算,NH4+的物质的量为0.05mol
。经计算,NH4+的物质的量为0.05mol 、
、 的物质的量分别为0.02mol和0.01mol,根据电荷守恒,得K+一定存在。
的物质的量分别为0.02mol和0.01mol,根据电荷守恒,得K+一定存在。
4. (海南省陵水县2007-2008学年度高三上学期第二次摸底考试)欲使NaCl、NH4Cl和SiO2的混合物分开,其必要的操作为
A.升华、溶解、过滤、蒸发 B.溶解、过滤、蒸发、分液
C.加热、溶解、过滤、结晶 D.溶解、过滤、分馏、结晶
[解析]利用NaCl、NH4Cl和SiO2的化学性质,先加热使NH4Cl分解再化合,然后加水溶解,过滤出SiO2,最蒸发结晶滤液得到NaCl。
[答案]C
3. (福建安溪八中2009届高三7月份质量检测试题)现有如下5种无色溶液:NaAlO2、KOH、NaCl、MgCl2、稀氨水,若要将其一一鉴别开来,至少需要用多少种试剂
(福建安溪八中2009届高三7月份质量检测试题)现有如下5种无色溶液:NaAlO2、KOH、NaCl、MgCl2、稀氨水,若要将其一一鉴别开来,至少需要用多少种试剂
A.1种 B.2种 C.3种 D.不用试剂
 [解析]依据题目中的5种溶液,首先闻到有刺激性气味的是稀氨水,然后取剩余的四种溶液少许,分别向其中滴加氨水,有白色沉淀产生的是MgCl2溶液,最后取剩余的三种溶液少许,分别向其中滴加AlCl3溶液,一开始产生白色沉淀的是NaAlO2,一开始无沉淀随着AlCl3溶液滴加又产生白色沉淀的是KOH,一直无明显现象的是NaCl。因此要将其一一鉴别开来,至少需要用1种试剂即可。
[解析]依据题目中的5种溶液,首先闻到有刺激性气味的是稀氨水,然后取剩余的四种溶液少许,分别向其中滴加氨水,有白色沉淀产生的是MgCl2溶液,最后取剩余的三种溶液少许,分别向其中滴加AlCl3溶液,一开始产生白色沉淀的是NaAlO2,一开始无沉淀随着AlCl3溶液滴加又产生白色沉淀的是KOH,一直无明显现象的是NaCl。因此要将其一一鉴别开来,至少需要用1种试剂即可。
[答案]A
2.(福建省南安华侨中学2009届高三上学期第二次月考)下列说法正确的是
A.苯酚、硫氰化钾、乙酸、氢氧化钾四种溶液可用FeCl3溶液一次鉴别
B.CH3CH2OH、CH2=CHCOOH、CH3CHO、CH3COOH四种溶液可用新制Cu(OH)2一次鉴别
C.除去KCl溶液中的少量MgCl2:加入适量的NaOH溶液,过滤
D.KCl溶液中混有少量KI,可通入足量Cl2后,再用乙醇进行萃取、分液
[解析]A项中苯酚遇FeCl3溶液呈紫色,硫氰化钾遇FeCl3溶液呈血红色,乙酸遇FeCl3溶液无明显现象,氢氧化钾遇FeCl3溶液产生红褐色沉淀,故可用FeCl3溶液将四种溶液一次鉴别出;B项中CH2=CHCOOH和CH3COOH均使新制Cu(OH)2溶解,二者不易鉴开;C项中除去Mg2+又混入Na+;D项中乙醇不能作萃取剂,因其与水任意比互溶。
[答案]A
1.(福建安溪八中2009届高三7月份质量检测试题)用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按题图所示步骤分开五种离子。则溶液①、②、③、④是

A.①NaCl ②NaOH ③NH3·H2O ④H2SO4
B.①H2SO4 ②NaOH ③NH3·H2O ④NaCl
C.①H2SO4 ②NH3·H2O ③NaOH ④NaCl
D.①NaCl ②NH3·H2O ③NaOH ④H2SO4
[解析]从题目所给的图示步骤综合分析,可以看出第①步分离五种离子中的一种离子,只能是Ag+与 结合生成AgCl沉淀。第②步产生的沉淀和剩余的溶液分别分离出两种离子,应用NH3·H2O沉淀出Fe3+和Al3+,然后用强碱NaOH溶液将Fe(OH)3和Al(OH)3分离。第④步用
结合生成AgCl沉淀。第②步产生的沉淀和剩余的溶液分别分离出两种离子,应用NH3·H2O沉淀出Fe3+和Al3+,然后用强碱NaOH溶液将Fe(OH)3和Al(OH)3分离。第④步用 将Ba2+和K+分离,故答案为D
将Ba2+和K+分离,故答案为D
[答案]D
10. 某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。甲、乙、丙三位学生分别
设计了从该污水中回收纯净的金属铜的方案(见下图)

 (1)甲、乙、丙提出的实验方案是否能得到纯净的金属铜?甲 ,乙 ,丙 (填“能”或“不能”)。
(1)甲、乙、丙提出的实验方案是否能得到纯净的金属铜?甲 ,乙 ,丙 (填“能”或“不能”)。
 (2)在能制得纯净的铜的方案中,哪一步操作会导致环境污染? 。应增加哪些措施防止污染?
。
(2)在能制得纯净的铜的方案中,哪一步操作会导致环境污染? 。应增加哪些措施防止污染?
。
[解析]结合污水中Mg2+、Fe3+、Cu2+、Hg2+四种离子的性质,甲方案中滤渣中有Mg(OH)2、Cu(OH)2、Fe(OH)3及Hg(OH)2,加热得氧化物为CuO、MgO、Fe2O3及HgO,通入H2加热后Cu中含有Fe及MgO。乙方案中加过量的铁粉后滤渣中含有铜粉、铁粉及单质汞,最后Cu中含有Fe。方案丙中加过量的铁粉后滤渣中含有铜粉、铁粉及单质汞,再滴加稀盐酸除去铁粉,后滤渣只有铜粉及汞,通入H2并加热知得到纯净的铜粉,加热时汞也挥发成汞蒸气,对环境造成污染,为防止污染,将汞蒸气冷凝回流,回收变废为宝。
[答案](1)不能;不能;能。(2)丙方案的第③步;增加冷凝回流装置。
[专题综合]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com