
23.(8分)工业制备的高锰酸钾是锰的重要化合物和常用的氧化剂。以下附图是工业上用软锰矿制备高锰酸钾的一种工艺流程。
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是_____(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
(2)上述流程中可以循环使用的物质有 、 (写化学式)。(3)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
 (4)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
(4)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
22.向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。
向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是 ( )
A. B.
B.
C.n=m+17Vc D.  m<
m< <
<
21.钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示 ( )
① 3Fe+NaNO2+5NaOH = 3Na2FeO2+H2O+NH3↑;
② 6Na2FeO2+NaNO2+5H2O = 3 Na2Fe2O4+ NH3↑+7NaOH;
③ Na2FeO2+ Na2Fe2O4+2H2O = Fe3O4+4NaOH;
下列说法不正确的是
A.该生产过程会产生污染 B.反应②中的氧化剂是NaNO2
C.整个反应过程中每有16.8gFe参加反应转移0.8mol电子
D.反应①②③均是氧化还原反应
20.某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使红色石蕊试纸变蓝。由该实验能得到的正确结论是( )
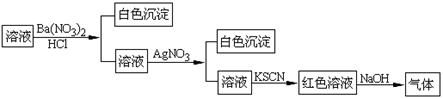
A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
19. 现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图所示的相互关系,图中每条连线两端的物质可以发生化学反应。下列
现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图所示的相互关系,图中每条连线两端的物质可以发生化学反应。下列
推断不合理的是 ( )
A.X一定为H2SO4
B.Y一定为K2CO3
C.Z可能是氯水
D.M可能为FeSO4
18.铜的冶炼大致可分为:
① 富集,将硫化物矿进行浮选;
② 焙烧,主要反应为:2CuFeS2+4O2=====Cu2S+3SO2+2FeO(炉渣);
③ 制粗铜,在1200℃发生的主要反应为:
2Cu2S+3O2 =====2Cu2O+2SO2 ;2Cu2O+ Cu2S ===== 6Cu+SO2↑;
④ 电解精炼铜。
下列说法正确的是 ( )
A.冶炼过程中的尾气可用来制硫酸
B.上述过程中,由1mol CuFeS2制取1molCu时共消耗2 molO2
C.在反应2Cu2O+ Cu2S == 6 Cu+SO2↑中,只有Cu2O作氧化剂
D.电解精炼铜的过程中,每转移1mol电子时,阳极溶解铜的质量为32 g
17.在给定条件下,下列加点的物质在化学反应中完全消耗的是 ( )
A.用50mL 8mol/L的浓盐酸与10g二氧化锰共热制取氯气
B.向100mL 3mol/L的硝酸中加入5.6g铁
C.标准状况下,将1g铝片投入20mL 18.4mol/L的硫酸中
D.在5×107Pa、500℃和铁触媒催化的条件下,用氮气和氢气合成
16.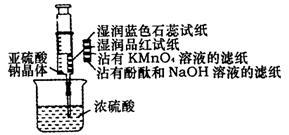 如右图所示,在注射器中加入少量
如右图所示,在注射器中加入少量
Na2SO3晶体,并吸入少量的硫酸
(以不接触纸条为准)。则下列有关
说法正确的是 ( )
A.蓝色石蕊试纸先变红后褪色
B.沾有KMnO4溶液的滤纸褪色,证
明了SO2的漂白性
C.品红试纸褪色,证明了SO2的漂白性
D.沾有酚酞和NaOH溶液的滤纸褪色,证明了SO2的漂白性
14.已知在热的碱性溶液中,NaClO发生如下反应:3NaClO→2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是 ( )
A.NaCl、NaClO B.NaCl、NaClO3
C.NaClO、NaClO3 D.NaClO3、NaClO4
|
下列结论正确的是 ( )
A.肯定含有的离子是③④⑤ B.肯定没有的离子是②⑤
C.可能含有的离子是①⑥ D.不能确定的离子是③⑥
13.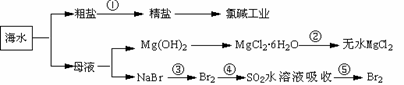 海洋中有丰富的食品、矿产,能源、药物和水产资源等(如下图所示),
海洋中有丰富的食品、矿产,能源、药物和水产资源等(如下图所示),
下列有关说法正确的是 ( )
A.大量的氰、磷废水排入海洋,易引发赤潮
B.第②步中结晶出的MgCl2·6H20可在空气中受热分解制无水MgCl2
C.在第③④⑤步中溴元素均被氧化
D.第①步中除去粗盐中的S042-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2C03溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com