
6.已知正六边形ABCDEF,下列向量的数量积最大的是 ( )
A. B.
B. C.
C. D.
D.
5.在△ABC中, 是角A,B,C的对边,若
是角A,B,C的对边,若 成等比数列,
成等比数列, ,则
,则
( )
A. B.
B. C.
C. D.
D.
4.已知函数 则函数
则函数 的最大值是 ( )
的最大值是 ( )
A. B.
B. C.
C. D.2
D.2
3.把函数 的图象向左平移
的图象向左平移 个单位,所得曲线的一部分如图所示,则
个单位,所得曲线的一部分如图所示,则 的值分别为
( )
的值分别为
( )
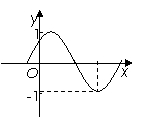 A.2,
A.2,
B. 2,
C.1,
D. 1,
2.已知角 的终边上一点的坐标为
的终边上一点的坐标为 则角
则角 的最小正值为 ( )
的最小正值为 ( )
A. B.
B. C.
C. D.
D.
1.若集合 则满足条件的实数x的个数有
(
)
则满足条件的实数x的个数有
(
)
A. 1个 B.2个 C.3个 D. 4个
27.(12分)进行胃部透视时,常在检查之前服用“钡餐”,其主要成分是硫酸钡。
(1)25℃时,已知胃液的pH在0.9-1.5之间,请问___ 。(填“能”或“不能”)用碳酸钡代替硫酸钡作为“钡餐”使用,简述你做出判断的理由_ 。
(2)当人体中Ba2+浓度达到2×10-3mol·L-1时,就会对健康产生危害,若误将氯化钡当做食盐食用,请计算说明是否可以通过服用5%的硫酸钠溶液(约0.36mol·L-1)有效除去胃中的Ba2+。(25℃时,硫酸钡的溶度积常数Ksp=1.1×10-10)
。
(3)环境监测某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
① Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;② I2+2S2O32-=2I-+S4O62-。
试计算该工厂废水中Ba2+的物质的量浓度。
26.(13分)某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了以下实验流程图:
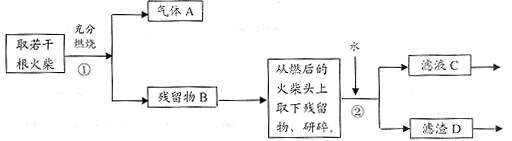
请回答以下问题:
(1)为验证气体A,按右图所示进行实验:若能
观察到 的现象,即可证明火柴头上含
有S元素。
 (2)写出步骤①中发生反应的化学方程式
。
(2)写出步骤①中发生反应的化学方程式
。
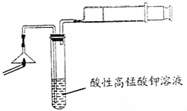
(3)步骤②的实验操作装置如右下图所示,该操
作的名称是 。
(4)要证明火柴头中含有Cl元素的后续实验步
骤是
。
(5)有学生提出检验火柴头上KClO3另一套实验方案:

有关的离子反应方程式为 ,有人提出上述方法中出现白色沉淀并不能
充分说明火柴头上KClO3的存在,其理由是 。
(6)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5次实验。
|
实验次数 |
H2O2溶液质量分数% |
H2O2溶液用量/毫升 |
物质D用量/克 |
反应温度/℃ |
收集气体体积/毫升 |
所需时间/秒 |
|
① |
30 |
5 |
0 |
85 |
2 |
3.8 |
|
② |
15 |
2 |
0.1 |
20 |
2 |
2.8 |
|
③ |
15 |
2 |
0.2 |
20 |
2 |
2.2 |
|
④ |
5 |
2 |
0.1 |
20 |
2 |
7.4 |
|
⑤ |
30 |
5 |
0 |
55 |
2 |
10.5 |
由上表可知,实验①和⑤能证明温度越高,化学反应速率越快,实验 和
证明物质D的用量越大,反应速率越快。
25. (9分)用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
(9分)用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
(1)图中D装置在实验中的作用是 。
(2)若 A为30%H2O2溶液,B为MnO2 ,C盛有
氢硫酸(H2S)饱和溶液,旋开E后,C中出现
浅黄色浑浊的现象,写出C中发生反应的化学
方程式为 。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀
粉溶液,旋开E后,C中的现象是 ;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被Cl2氧化为HIO3(碘酸为强酸),写出该反应的离子反应方程式 。
(4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是 ,C中发生反应的离子方程式为 。
24.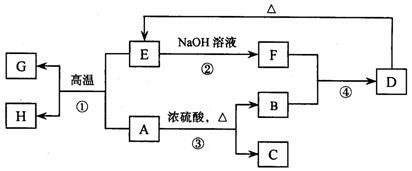 (8分)已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。
(8分)已知A、B、C、D、E、F、G、H 可以发生如下图所示的转化,反应中部分生成物已略去。其中,A、G为同一主族元素的单质,B、C、H在通常情况下为气体,化合物C是一种形成酸雨的大气污染物。
请填空:
(1)H的名称是 。
(2)E的两种用途是 、 。
(3)反应③的化学方程式是 。
(4)反应④的离子方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com