
2.化学平衡状态
化学平衡状态特征有
1.化学平衡的研究对象是
1、可逆反应 的反应。如: 。
不可逆反应 的反应。如:
24.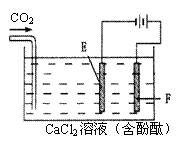 (10分)下图为持续电解饱和CaCl2水溶液的装置(以铂为电极),电解l h后,将CO2连续通入电解液中,请回答有关问题。
(10分)下图为持续电解饱和CaCl2水溶液的装置(以铂为电极),电解l h后,将CO2连续通入电解液中,请回答有关问题。
(1)电解时F极发生 反应,电极反应式
为 ;
E极发生 反应,电极反应式为 ;
(2)电解时电解池中产生的现象是 ,
电解后持续通入CO2产生的现象是
。
23.(15分)已知2NO2(g) N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
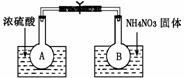
Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体。
 请回答:
请回答:
(1)A中的现象 ,B中的现象 ;
(2)由此可知,降低温度,该化学平衡向 (填“正”或“逆” )反应方向移动;
(3)该化学反应的平衡常数表达式为 ,升高温度,该反应中NO2的转化率将 (填“增大”、“减小”或“不变”)。
Ⅱ.在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭。
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深。
①推进针筒后颜色变深的原因是 ;
②一段时间后气体颜色又变浅的原因是 ;
③由此实验得出的结论是 。
(2)将第三支针筒活塞拉至20cm3处,该同学观察到的现象是
;在此过程中,该反应的化学平衡常数将 (填“增大”、“减小”或“不变”,下同),NO2的转化率将 。
22.(10分)利用反应:Zn+2Fe ===Zn
===Zn +2Fe
+2Fe 设计一个带盐桥的原电池。并在下面方框内画出实验装置图,并指出:
设计一个带盐桥的原电池。并在下面方框内画出实验装置图,并指出:
(1)正极为 ,电极反应式为 。
(2)负极为 ,电极反应式为 。
(3)此装置中盐桥的作用为 。
21.(5分)氢能是高效、清洁能源,制氢技术的研究开发是氢能利用的必由之路。燃料水蒸气重整法是一种有效、经济、广泛采用的制氢方法,它是通过水蒸气与燃料间的反应来制取氢气的。
(1)在催化剂作用下,天然气和水蒸气反应可制得一氧化碳和氢气,已知该反应每制得1kg氢气需要吸收3.44×104 kJ热量。写出该反应的热化学方程式 ;
(2)CO可继续与水蒸气反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.0kJ·mol-1。若将1mol甲烷与足量水蒸气充分反应得到1molCO2,该反应的焓变ΔH= ;
(3)欲制得较纯净的氢气,可将(2)中充分反应后的气体通过足量的烧碱溶液,写出该反应的离子方程式 ;
20.将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应NO2(g)+CO(g) CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中的CO2的体积分数是 ( )
CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中的CO2的体积分数是 ( )
A. B. C. D.
第Ⅱ卷(非选择题 共40分)
19.在容积不变的密闭容器中,一定条件下发生反应:2A(?) B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
B(g)+C(s),达到化学平衡后,升高温度,容器内气体的密度增大,则下列叙述正确的是( )
A.若正反应是吸热反应,则A为非气态
B.若正反应是放热反应,则A为非气态
C.在平衡体系中加入少量C,该平衡向逆反应方向移动
D.改变压强对该平衡的移动一定无影响
18.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即可构成CH4燃料电池。已知通入CH4的一极,其电极反应式是:CH4+10OH--8e-= CO32-+7H2O;通入O2的一极,其电极反应式是:O2+2H2O+4e-= 4OH-,该电池放电时,下列有关叙述中,不正确的是( )
A.通入CH4的电极为负极
B.正极发生氧化反应
C.燃料电池工作时溶液中的阴离子向负极移动
D.该电池使用一段时间后应补充KOH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com