
3、在等温等容条件下,有反应2A(g)+2B(g)⇌C(g)+3D(g),现分别从两个途径建立平衡:Ⅰ:A、B的起始浓度均为2mol·L-1;Ⅱ:C、D的起始浓度分别为2mol·L-1、6mol·L-1。下列叙述正确的是:( AD )
A.Ⅰ、Ⅱ两个途径最终达到平衡时,容器内混合气体中各种成分体积分数相同
B.Ⅰ、Ⅱ两个途径最终达到平衡时,容器内混合气体中各种成分体积分数不相同
C.达平衡时,Ⅰ途径反应速率V1等于Ⅱ途径反应速率V2
D.达平衡时,Ⅰ平衡混合气体的密度为Ⅱ平衡密度的1/2
2、已经建立化学平衡的可逆反应: A + B  C, 改变条件, 使化学平衡向正反应方向移动, 有关叙述中正确的是:( B )
C, 改变条件, 使化学平衡向正反应方向移动, 有关叙述中正确的是:( B )
A. 生成物的百分含量(即质量分数)一定增大
B.生成物的产量一定增大
C. 反应物的转化率都增大 D. 反应物的百分含量都降低
1、在温度一定时, 于密闭容器中发生可逆反应: mA(气) + nB(气)  pC(气), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1,9
倍, 则下列叙述中正确的是:(AD )
pC(气), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1,9
倍, 则下列叙述中正确的是:(AD )
A. 平衡向逆反应方向移动 B. C气体的体积分数增大
C. 气体A的转化率升高 D. m + n < p
[例1](06苏州二模)某密闭容器中进行如下反应:X(g)+2Y(g) 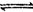 2Z(g),若最初时只加入X、Y两种物质,要使平衡时反应物总物质的量与生成物的物质的量相等,则x、Y的初始物质的量之比
2Z(g),若最初时只加入X、Y两种物质,要使平衡时反应物总物质的量与生成物的物质的量相等,则x、Y的初始物质的量之比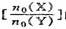 的范围应满足
C
的范围应满足
C
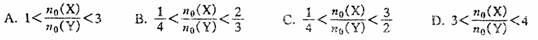
 [例2]在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增大一倍,达新平衡时,B的浓度是原来的60%,则( )
[例2]在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增大一倍,达新平衡时,B的浓度是原来的60%,则( )
A. 平衡向正反应方向移动了 B. 物质A的转化率减小了
C. B的质量分数增加了 D.a>b
[解析]本题旨在考查运用勒沙特列原理的技能。恒温下,体积增大一倍,即为压强减小的过程,平衡向气体体积增大的方向移动。已知B的浓度不是原来的 (50%),而是60%,故平衡必向生成B的方向移动。
(50%),而是60%,故平衡必向生成B的方向移动。
[答案]AC
[例3]将2mol
H2O和2mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:2H2O(g)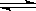 2H2+O2
2CO+O2
2H2+O2
2CO+O2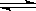 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是 和 ,或 和 。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为 n(O2)平=a mol, n(CO2)平=b mol。试求n(H2O)平= 。(用含a、b的代数式表示)
[解析](1)题设情境中同时存在两个反应的化学平衡,涉及5种气体。根据物质守恒可以写出3个关系式:
①H原子守恒:2n(H2O)平+2 n(H2)平=4mol
②O原子守恒:n(H2O)平+2 n(O2)平+ n(CO)平+2 n(CO2)平=4mol
③C原子守恒:n(CO)平+ n(CO2)平=2mol
由①可知,n(H2O)平和 n(H2)平两个量是直接相关的,知其一,则知其二;由③可知,n(CO)平和 n(CO2)平的关系也是如此。若同时n(H2O)平和 n(H2)平两个量,或n(CO)平和 n(CO2)平两个量,实际上只相当于增加了一个已知条件。
(2)将“n(O2)平=a mol、n(CO2)平=b mol”代入②、③,即可求n(H2O)平。
第(2)问也可直接求解。
[答案](1)H2O H2, CO CO2 (2)(2-2a-b) mol
2、化学平衡中的常用方法
(1) “始、转、平”三段分析法
mA(g) + nB(g) 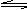 pC(g) + qD(g)
pC(g) + qD(g)
起始量 a b 0 0
变化量 x nx/m px/m qx/m
平衡量 a-x b- nx/m px/m qx/m
(2) 差量法(△V 、 △n)
若定温、定容,已知平衡前后压强变化,由理想气体状态方程PV=nRT 推知
P(始)/P(平)= n(始)/n(平),从而求出平衡前后物质的量的差量(△n)
若定温、定压,已知平衡前后密度变化,由理想气体状态方程PV=nRT 推知气体的密度与摩尔质量成正比,由于前后气体总质量不变,即ρ(始)/ρ(平)= n(平)/n(始),从而求出平衡前后物质的量的差量(△n)。
(3).混合气体平均式量(M)的计算
①若反应物、生成物均为气体,根据M=m/n ,平衡移动前后,混合气体总质量不变,若平衡向气体体积增大的方向移动,混合气体平均式量变小;若平衡向气体体积减小的方向移动,混合气体平均式量则变大。
②若反应物或生成物中有非气态物质,则混合气体平均式量可能不变、变小或变大。例如,在密闭容器中进行可逆反应:C(S)+H2O(g)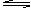 CO(g)+H2(g)若压缩容器的体积,混合气体的平均式量如何变化?解此题,可假设压缩前混合气体平均式量为M1,气体总物质的量为n,压缩后到达新平衡,消耗了x mol CO和x mol H2,同时生成了x mol C和x mol H2O,所以混和气体总物质的量减小了x mol,故压缩后到达新平衡混合气体平均式量可表示为:
CO(g)+H2(g)若压缩容器的体积,混合气体的平均式量如何变化?解此题,可假设压缩前混合气体平均式量为M1,气体总物质的量为n,压缩后到达新平衡,消耗了x mol CO和x mol H2,同时生成了x mol C和x mol H2O,所以混和气体总物质的量减小了x mol,故压缩后到达新平衡混合气体平均式量可表示为:
M2=
=
= ∴ M2-M1=
∴ M2-M1=
由上式可知:
若: ①M1=12 则M2=M1,到达新平衡混合气平均式量不变;
②M1>12 M2>M1,到达新平衡混合气平均式量变大;
③M1<12 M2<M1,到达新平衡混合气平均式量变小。
(4).“虚拟容器”法
该法适用于在定温、定容条件下,各种反应物、或生成物、或反应物和生成物同时增大(减小)相同倍数,可虚拟一个容器,容器的体积扩大(缩小)相应的倍数,此时两容器中建立的平衡完全等效,然后将虚拟的容器压缩(扩大)至原容器大小,相当于增大(减小)压强,再根据压强对平衡移动的影响来确定转化率等的变化情况。
(5).可逆反应“不为零”原则
该法适用于确定改变条件,平衡移动后,某些物质的浓度范围。比如在一定温度下,将1molCO和1 mol 水蒸气通入密闭容器中反应:CO+H2O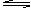 CO2+H2,达平衡后测得CO2 为0.6 mol,再通入4mol水蒸气,达新平衡后CO2的物质的量可能为多少? 加入水蒸气平衡右移,故新平衡时CO2的物质的量大于0.6
mol,增大了水蒸气的量,提高CO的转化率,即使CO完全转化,最多生成CO2 1 mol, 根据可逆反应平衡时各物质的量“不为零”原则,所以0.6 mol<n(CO2)<1
mol。
CO2+H2,达平衡后测得CO2 为0.6 mol,再通入4mol水蒸气,达新平衡后CO2的物质的量可能为多少? 加入水蒸气平衡右移,故新平衡时CO2的物质的量大于0.6
mol,增大了水蒸气的量,提高CO的转化率,即使CO完全转化,最多生成CO2 1 mol, 根据可逆反应平衡时各物质的量“不为零”原则,所以0.6 mol<n(CO2)<1
mol。
1、合成氨工业
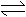 (1)选择适宜温度:根据N2+3H2 2NH3+Q这一反应的特点,运用
和
(1)选择适宜温度:根据N2+3H2 2NH3+Q这一反应的特点,运用
和
的理论来选择适宜条件。该反应为可逆、体积减小、正反应为放热等特点。
(2)选择适宜的压强:为何强调适宜?压强越大、有利于NH3的合成,但压强太大,所需 大,材料强度 ,设备制造要求 ,成本 ,选择2×107~5×107Pa压强
(3)选择适宜催化剂是因为
合成氨的适宜条件为: 。同时不断将氨分离出来,并将原料气循环使用。
⑶ 合成氨工业简述
① 原料气的 、净化和 ;② 氨的合成以及原料气的 利用;③ 氨的 。
(4)、合成氨工业的发展前景
①德国化学家哈伯于1913年实现了合成氨的工业化生产。
②合成氨的条件将随科技进步、动力、材料、设备等条件的改善而改变。
③研究新型催化剂,在较低的温度下合成氨。
12.⑴ 0.2 mol ⑵ SO2、NO2 ⑶ 1.9
|
 ⑵
⑵
⑶ 分析上表数据不难看出,当m=2时,CO的转
化率较高,而这时平衡混合气中CH3OH的体积分数
最高。故最佳比为:V(H2)∶V(CO)=2∶1
第十五讲 化学平衡及其影响因素(第二课时)
11.⑴ < 放热 ⑵ < < ⑶ 因为OG段表示的温度、压强均高于OH段,所以反应速快,到达平衡所需的时间少,故b曲线的OG段比a曲线的OH段陡 ⑷ HE段相对于GF段是在低温、低压条件下到达的平衡,因为该可逆反应正反应是放热、体积增大的反应,故降温、减压,平衡向正反应方向移动,C的含量增大,故a曲线的HE段高于b曲线的GF段
13.在763K,3.04×104Pa时,用CO和H2作为原料合成CH3OH,存在下列平衡:
|
m |
a |
y |
|
1 |
0.25 |
|
|
2 |
0.45 |
|
|
3 |
|
19.35% |
CO(g)+2H2(g)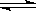 CH3OH(g)。当原料中H2和CO的比例不同时,对CO的转化率及平衡混合物中CH3OH的体积分数都有影响。⑴
设H2和CO的起始物质的量之比为m,平衡时CO的转化率为a ,平衡混合物中CH3OH的体积分数为y,试推断m、n、y三者的相互关系,并以y=f(a,m)的函数表达式表示出来 ;⑵
将下表已知数据代入你导出的表达式中进行计算,把结果填入有关的表格中:
CH3OH(g)。当原料中H2和CO的比例不同时,对CO的转化率及平衡混合物中CH3OH的体积分数都有影响。⑴
设H2和CO的起始物质的量之比为m,平衡时CO的转化率为a ,平衡混合物中CH3OH的体积分数为y,试推断m、n、y三者的相互关系,并以y=f(a,m)的函数表达式表示出来 ;⑵
将下表已知数据代入你导出的表达式中进行计算,把结果填入有关的表格中:
⑶ 根据上表数据,判断用CO和H2合成CH3OH时,CO和H2的最佳体积比是多少?并简述选出依据。
课后练习:1.C 2.BC 3.D 4.C 5.C 6.C 7.A 8.AB 9.C 10.A
12.将4 mol SO3气体和4 mol NO置于2 L容器中,一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):2SO3(g) 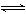 2SO2+O2、2NO+O2
2SO2+O2、2NO+O2 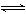 2NO2。⑴ 当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1 mol、n(NO2)=3.6 mol,则此时SO3气体的物质的量为
;⑵ 当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和 ,或NO和 (填它们的分子式);⑶ 在其它条件不变的情况下,若改为起始时在1 L容器中充入2 molNO2和2 molSO2,则上述两反应达到平衡时,c (SO2)平= mol/L。
2NO2。⑴ 当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1 mol、n(NO2)=3.6 mol,则此时SO3气体的物质的量为
;⑵ 当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和 ,或NO和 (填它们的分子式);⑶ 在其它条件不变的情况下,若改为起始时在1 L容器中充入2 molNO2和2 molSO2,则上述两反应达到平衡时,c (SO2)平= mol/L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com