
21.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,将按A题评分。
A.砷化镓(GaAs)属于第三代半导体,用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。砷化镓的晶胞结构如右图。试回答:
 (1)As的核外电子排布式为 。
(1)As的核外电子排布式为 。
(2)砷化镓晶胞中所包含的Ga原子个数为 。
(3)下列说法正确的是 (填字母)。
A.砷化镓晶胞结构与NaCl相同
B.第一电离能:As>Ga
C.电负性:As>Ga
D.砷化镓晶体中含有配位键
E.半导体GaP与GaAs互为等电子体
(4)砷化镓是将(CH3)3Ga和AsH3用MOCVD方法在700℃时制备得到。AsH3的空间形状为 ,(CH3)3Ga中镓原子的杂化方式为 。
(5)AsH3沸点比NH3低,其主要原因是 。
20.(8分)锌铝合金的主要成分有Zn、Al、Cu、Si等元素。实验室测定其中Cu含量的步骤如下:①称取该合金样品1.1g,用HCl和H2O2溶解后,煮沸除去过量H2O2,过滤,滤液定容于250mL容量瓶中。
②用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3-4,加入过量KI溶液(生成CuI和I2)和指示剂,用0.01100mol×L-1Na2S2O3溶液滴定生成的I2至终点(反应:I2 + 2S2O32- = 2I- + S4O62-),消耗Na2S2O3溶液6.45mL。
⑴写出步骤①溶解Cu的离子方程式 。
⑵判断步骤②滴定终点的方法是 。
⑶计算合金中Cu的质量分数。
19.(12分)已知:① 乙醛甲基上的氢原子的活性都很强,可与甲醛发生如下反应:

 ……
……
② 
③
现以CH3CH=CHCH2CH=CH2为原料来合成有机物K,合成路线如下:
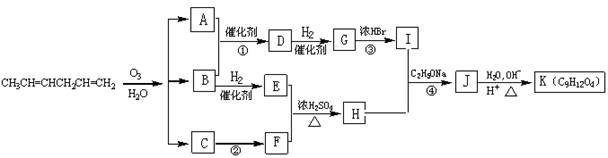
请回答下列问题:
⑴已知反应①中A、B的物质的量之比为3︰1,则反应①的化学方程式为 。
⑵反应④的化学方程式为 。
⑶写出下列反应的反应类型:② ;③ 。
⑷L为K的同分异构体,已知L遇FeCl3溶液呈紫色,分子中无甲基且苯环上的一氯代物只有一种,试写出三种L可能的结构简式 。
⑸根据上述转化关系,写出以丙烯为原料合成 的合成路线图(无机原料任选)。
的合成路线图(无机原料任选)。
18.(8分)乙酸苯甲酯可提高花或果的芳香气味,常用于化妆品工业和食品工业。下图是乙酸苯甲酯的一种合成路线(部分反应物、产物和反应条件略去)。

请回答:
(1)运用逆合成分析法推断,C的结构简式为 。


(2)D + → 的化学方程式为

(3)与 互为同分异构体的芳香族化合物有 种,其中一种同分异构体的核磁共振
氢谱有三种类型氢原子的吸收峰,该同分异构体的结构简式为 。
17.(12分)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。



(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤3:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1 (NH4)2Fe(SO4) 2标准溶液滴定至终点,消耗(NH4)2Fe(SO4) 2溶液V1 mL。滴定时发生的反应为:Fe2++Cr2O72-+H+→Fe3++Cr3++H2O(未配平)
① 写出步骤2中发生反应的离子方程式 。
② 根据上述实验数据,测定该溶液中K2FeO4的浓度为 mol·L-1(用含字母的代数式表示)。
16、(10分)氯化亚铜是一种重要的化工产品,常用作有机合成催化剂, 还可用于颜料, 防腐等工业。该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色。已知pH为5时,+2价铜已开始以碱式盐的形式沉淀。某兴趣小组去一家回收含铜电缆废料的工厂做社会调查,技术人员向他们展示了处理废料的综合利用方案:
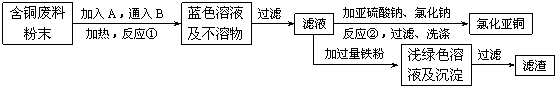

⑴ 加入的A是 ,通入的B是 。
⑵ 反应②的离子方程式是 。

 为提高Cu2Cl2的产率,常在反应②的溶液中加入适量稀碱溶液,控制pH为3.5。这样做的目的是
。
为提高Cu2Cl2的产率,常在反应②的溶液中加入适量稀碱溶液,控制pH为3.5。这样做的目的是
。
⑶ 保持各反应物的最佳配比,改变温度,测得Cu2Cl2产率的变化如下图所示。则溶液温度控制在 时,Cu2Cl2的产率已达到94%,当温度高于65℃时,Cu2Cl2产率会下降,其原因可能是 。
15.(10分)维生素C(C6H8O6,相对分子质量为176)可溶于水,具有强还原性,在碱性溶液中易被空气氧化,在酸性介质中较为稳定。维生素C通常用标准I2溶液(I2在水中溶解度很小,易溶于KI溶液,I2+I– I3–,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如下:
I3–,故标准I2溶液应配成I2的KI溶液)进行滴定,原理如下:

(1)滴定过程中应选用 (填酸式或碱式)滴定管盛放标准I2溶液,滴定所用的指示剂为 ,出现 现象时即为滴定终点。
(2)待测维生素C溶液在配制过程中,可以加入下列试剂中的 (填字母)
 A.0.1
mol·L-1 CH3COOH B.0.1 mol·L-1 HNO3
A.0.1
mol·L-1 CH3COOH B.0.1 mol·L-1 HNO3
C.0.1 mol·L-1 NaOH D.0.1 mol·L-1 Na2SO3
(3)配制一定物质的量浓度的标准I2溶液所需玻璃仪器有 (填字母)
A.容量瓶 B.胶头滴管 C.玻璃棒 D.烧杯 E.量筒
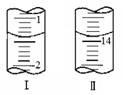
(4)将1.0 g 维生素样品制成100 mL溶液,取25 mL用0.1 mol·L-1的I2溶液滴定,滴定前后滴定管中示数如图,则样品中维生素C的质量分数为 。
14、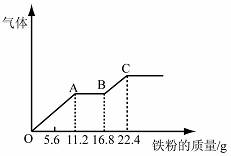 某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。
下列分析或结果错误的是
A.原混合酸中NO3-物质的量为0.2 mol
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为5 mol·L-1
第Ⅱ卷(非选择题 共72分)
13. 氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图。
氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如右图。
4NH3(g)+5O2(g) 4NO(g)+6H2O(g)
△H=-905 kJ·mol-1 ①
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
△H=-1268 kJ·mol-1 ②
下列说法中正确的是
A.工业上氨催化氧化生成 NO时,温度应控制在
780-840℃之间
B.工业上采用物料比n(O2)/n(NH3)在1.7-2.0,主要是为了提高反应速率
C.加压可提高NH3生成NO的转化率
D.N2氧化为NO的热化学方程式为:N2(g)+O2(g) 2NO(g) △H=+181.5
kJ·mol-1
2NO(g) △H=+181.5
kJ·mol-1
12.设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的有
①0.25molNa2O2中含有的阴离子数为0.5NA
②7.5gSiO2晶体中含有的硅氧键数为0.5NA
③1 mol α-氨基乙酸(甘氨酸)分子中存在10 NA对共用电子
④250mL2mol/L的氨水中含有NH3·H2O的分子数为0.5NA
⑤3.0 g淀粉和葡萄糖混合物中共含碳原子数为0.1NA
⑥18g D2O(重水)完全电解,转移NA个电子
⑦标准状况下,2.24L CHCl3含有的分子数为0.1NA
⑧电解精炼铜时,当阳极溶解32 g铜时,转移的电子数为NA个
A.2个 B.3个 C.4个 D.5个
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com