
21.(8分)某工厂用纯度为75℅黄铁矿(主要成分是FeS2,)制硫酸,在燃烧过程中FeS2损失2℅,由SO2氧化SO3时,SO2的利用率为80℅,求该厂用10.0t求这种黄铁矿可生产98℅的硫酸多少吨?
20.(8分)在10℃和4×105Pa条件下,当反应aA(g)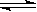 dD(g)+eE(g)建立平衡后,维持温度不变,逐步增大体系的压强,在不同压强下该反应建立平衡后物质D的浓度见下表(在增大压强的过程中无其他副反应发生):
dD(g)+eE(g)建立平衡后,维持温度不变,逐步增大体系的压强,在不同压强下该反应建立平衡后物质D的浓度见下表(在增大压强的过程中无其他副反应发生):
|
压强(Pa) |
4×105 |
6×105 |
1×106 |
2×106 |
|
D的浓度(mol/L) |
0.085 |
0.126 |
0.200 |
0.440 |
(1)压强从4×105增加到6×105Pa时,平衡向 反应方向移动(填“正”或“逆” )。理由是 。
(2)压强从1×106增加到2×106Pa时,平衡向 反应方向移动。此时平衡向该方向移动的两个必要条件是:① ,② 。
18.(6分)已知t℃、101kPa时容积可变的密闭容器中充入2molA和1molB,此
时容器的体积为V L,发生反应2A(g)+B(g)  2C(g),达平衡时,C的体积分
2C(g),达平衡时,C的体积分
数是0.4。
(1)若恒温恒压时,开始充入4molC,达平衡时C的体积分数是 ,容器的体积为 L。
(2)若另选一容积不变的密闭容器,仍控制温度为t℃,开始充入4molA和2molB,反应达平衡时C 的体积分数是0.4,压强为101kPa。则该容器的体积为
L。
19(14分).在一个1L的可变容积的密闭容器中,在某温度下加入一定量的C
(足量)和H2O(g)发生下列反应:C(s)+ H2O(g)  CO(g)+H2
CO(g)+H2
(g)
Ⅰ、(1)若保持容器容积不变,通入一定量氖气,则达到新平衡时H2O的转化
率 。保持压强不变,通入氖气使体系的容积增大一倍,则达到新
平衡时H2O的转化率 。(填“增大”或“减小”或“不变”)
(2)在反应达平衡后,保持容器容积不变,通入一定量H2O(g),则达到新平
衡时H2O百分含量 。保持容器容积不变,通入一定量物质的量比为1∶
1的CO和H2,则达到新平衡时H2O百分含量 。(填“增大”或“减
小”或“不变”)
(3)若保持压强不变,通入一定量H2O(g),则达到新平衡时H2O百分含
量 。保持容器压强不变,通入一定量物质的量比未1∶1的CO和H2,
则达到新平衡时H2O百分含量 。(填“增大”或“减小”或“不变”)
Ⅱ、若保持容器容积不变,开始时充入容器中的起始物质是①C(足量)、2mol H2O
(g);②C(足量)、2mol H2O(g)、1molCO;③C(足量)、2mol H2O(g)、1molCO、
1molH2;达到平衡时容器中H2O(g)浓度由小到大排列顺序
是 。(填序号)
17.(16分)一密闭容器中发生下列反应
N2+3H2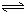 2NH3;ΔH<0,下图是某一时间段中反
2NH3;ΔH<0,下图是某一时间段中反
应速率与反应进程的曲线关系图。回答下列问题:
(1)处于平衡状态的时间段是______、_______、_______、____。
(2)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
_______________、_______________、______________。
(3)下列时间段中,氨的百分含量最高的是( )
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
16.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是………………………………………………………………( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
第Ⅱ卷(非选择题 共52分)
15.灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
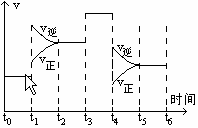 ③Sn(s、灰)
③Sn(s、灰) Sn(s、白) △H3=+2.1kJ·mol-1
Sn(s、白) △H3=+2.1kJ·mol-1
下列说法正确的是………………………………………………………………( )
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
14. 反应2A(g)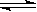 B(g)+Zc(g),在一定条件下达到新的平衡,密闭容器内压强增大p%,测得A的转化率为p%,则z的值为…………………………………( )
B(g)+Zc(g),在一定条件下达到新的平衡,密闭容器内压强增大p%,测得A的转化率为p%,则z的值为…………………………………( )
A.1 B.2 C.3 D.4
13.将气体A2和B2等物质的量注入容积为1L的密闭容器中反应生成C,平衡时测得c(A2)=0.58mol/L,则c(B2)=0.16mol/L,c(C)=0.84mol/L,则C的分子式为…………………………………………………………………………………( )
A.AB2 B.A2B4 C.AB D.A2B
12.对于反应:N2(g)+3H2(g)  2NH3(g)(正反应是放热反应) 的平衡体系,在其它条件不变时,采取下列措施,其中能既使正、逆反应速率增大,又能使反应物转化率增大的是……………………………………………………………( )
2NH3(g)(正反应是放热反应) 的平衡体系,在其它条件不变时,采取下列措施,其中能既使正、逆反应速率增大,又能使反应物转化率增大的是……………………………………………………………( )
A 增大体系压强 B 升温 C 加入催化剂 D 减小NH3的浓度
11.100ml 6mol/L H2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的…………………( )
A.Na2SO4(s) B. KNO3溶液 C.K2SO4溶液 D.(NH4)2SO4(s)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com