
29.由铜片、锌片和100mL稀硫酸溶液组成的原电池中,当铜片上产生2.24L(标准状态)气体时,硫酸恰好作用完,试计算:
(1)导线中转移的电子的物质的量?
(2)原稀硫酸溶液的物质的量浓度是多少?
28.用30g乙酸与46g乙醇反应,如果实际产率是67%,求可得到的乙酸乙酯的质量。
27.糖类是人体需要的重要营养素,淀粉是重要的一类糖。某同学为了探究淀粉的水解情况做了如下实验:在试管中加入0.5g淀粉和4mL20%的H2SO4溶液,加热3-4min,请回答下列问题:
(1)淀粉完全水解生成有机物的名称为 。
(2)若要确定淀粉没有完全水解,可取少量上述溶液加入 (填试剂的名称),应观察到 ;
(3)若要确定淀粉已经水解,需再取另外一份水解液先加入 (填试剂的名称),再加入 (填试剂的名称),加热,应观察到 。
五 计算题(12分,每题6分)
26.镁及其合金是一种用途广泛的金属材料,目前世界上60%的镁是从海水中提取。
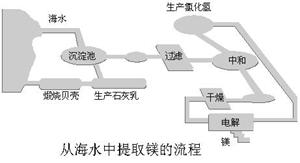
其步骤为:
① 将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
② 将石灰水加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③ 在Mg(OH)2沉淀中加入某试剂得到MgC12溶液,再经蒸发结晶得到MgC12· 6H2O;
④ 将MgC12· 6H2O在一定条件下加热得到无水MgC12;
⑤ 电解熔融的氯化镁可得到Mg。
请回答下列问题:
(1)步骤③中的蒸发量是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有蒸发皿、 、酒精灯、铁架台等。
(2)写出步骤②中发生反应的离子方程式:
(3)步骤③中加入的某试剂是 ,发生反应的化学方程式为: 。
(4)有同学认为:步骤②后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?为什么?
, 。
25.A的产量是衡量一个国家石油化工发展水平的标志,B是生活中常见的有特殊香味的饮料,D是生活中常见的具有刺激性气味的调料。根据下图变化关系回答下列问题:
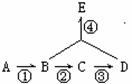
(1) 上述变化中属于加成反应的是 (填序号)。
(2) 分别写出下列变化的化学方程式
②:
④:
四 实验题(12分,每小题6分)
24.下图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格:
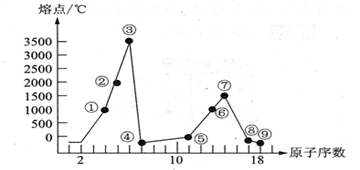
(1)③号元素在周期表的位置是____ 。
(2)⑤、⑥两种元素形成的最高价氧化物对应的水化物之间相互反应的离子方程式为_________________ _。
(3)⑦号元素的原子结构示意图为_______________。
22.煤、石油、天然气三大化石燃料依然是我们现阶段的主要能量来源。
(1)其中化石燃料的综合利用给我们的生产和生活带来了丰富的生产原料,三大合成材料是指: 、 、 。
(2)来自石油的乙烯能使溴水褪色,发生的是 反应,使酸性高锰酸钾溶液褪色是发生了 反应;来自煤的苯能使溴水褪色,是因为 。
23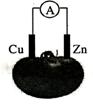 .利用Cu、Zn两种金属便可以完成能量的转化,例:将铜片和锌片用导线连接后插入苹果里,如右图所示,电流计指针发生偏转。
.利用Cu、Zn两种金属便可以完成能量的转化,例:将铜片和锌片用导线连接后插入苹果里,如右图所示,电流计指针发生偏转。
(1)在该水果电池中,铜为 极。
(2)负电极上的电极反应式为 。
三 推断题(12分,每空2分)
21.化学变化的本质是化学键的断裂和形成,回答下列问题
(1)在 ①Cl2 ②HCl ③NaOH ④Na2O2 四种物质中,存在离子键的是 ,存在极性共价键的是 ,存在非极性共价键的是 ,
(2)用电子式表示HCl的形成过程:
20.根据以下叙述回答下列问题.把0.6mol X气体和0.4mol Y气体混合于2L容器中,使它们发生反应:3X(气)+Y(气) 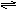
 nZ(气)+2W(气).5 min末已生成0.2 molW,若测知以Z浓度变化表示的平均反应速率为0.01 mol/(LZmin),则:(1)上述反应中系数n的值是( )
nZ(气)+2W(气).5 min末已生成0.2 molW,若测知以Z浓度变化表示的平均反应速率为0.01 mol/(LZmin),则:(1)上述反应中系数n的值是( )
A.1 B.2 C.3 D.4
第II卷
19.我国许多城市已经推广使用清洁燃料,如压缩天然气类、液化石油气类。这两类燃料的主要是
A.醇类 B.一氧化碳 C.氢气 D.烃类
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com