
2.肌肉注射时,药液进入人体后经过的一般途径是 ( )
A.血浆→组织液→淋巴→血浆→靶细胞
B.淋巴→血浆→组织液→血浆→靶细胞
 血浆→组织液→靶细胞
血浆→组织液→靶细胞
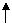
 C.组织液
C.组织液
淋巴
D.组织液→血浆→组织液→靶细胞
1.如图是人体某组织内各种结构示意图,A、B、C、D表示的是结构,①、②、③、④表示的是液体,有关此图的叙述不正确的是 ( )
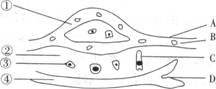 A.②可以进入A、C、D
A.②可以进入A、C、D
B.CO2浓度最高的液体是①
C.图中O2浓度最低的液体是③
D.①②③④组成了体液,其中①②④属于内环境
(二)判断方法
1、根据构成化合物的微粒间是以离子键还是以共价键结合来判断。一般来说,活泼的金属原子和活泼的非金属原子间形成的是离子键,同种或不同种非金属原子间形成的是共价键。
2、根据化合物的类型来判断。大多数碱性氧化物、强碱和盐都属于离子化合物;非金属氢化物、非金属氧化物、酸都属于共价化合物。
3、根据化合物的性质来判断。熔点、沸点较低的化合物(SiO2、SiC等除外)是共价化合物。溶于水后不能发生电离的化合物是共价化合物,熔化状态下能导电的化合物是离子化合物,不导电的是共价化合物。
[思考感悟](1)所有物质中都存在化学键吗?有化学键的断裂或生成就一定是化学反应吗?
(1)不是,稀有气体中无化学键。(2)不一定,如NaCl溶于水,属于物理变化。
[基础训练]
1、下列变化中:①I2升华,②烧碱溶于水,③NaCl溶于水,④HCl溶于水,⑤O2溶于水,⑥Na2O2溶于水。未发生化学键破坏的是①⑤;仅发生离子键破坏的是②③;仅发生共价键破坏的是④;既发生离子键破坏,又发生共价键破坏的是⑥。
2、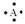 有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为 ,B原子L层的电子总数是K层的3倍;0.1molC单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为 ,B原子L层的电子总数是K层的3倍;0.1molC单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
(1)写出A、B、C、D元素的名称:A:碳,B:氧,C:镁,D:铝。
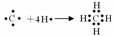 (2)D元素在周期表中属第3周期ⅢA族。
(2)D元素在周期表中属第3周期ⅢA族。
(3)用电子式表示A的气态氢化物的形成过程: 。
(4)A和B的单质充分反应生成化合物的结构式是:O=C=O。
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明?B与C形成的化合物是MgO应为离子化合物;检验方法为验证其熔融物是否导电,若导电则为离子化合物,否则为共价化合物。
3、已知X、Y、Z、W四种元素均是元素周期表中的短周期元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y与X形成的分子中有3个共价键。Z原子最外层电子数是次外层电子的3倍,试推断:
 (1)X、Z两种元素的元素符号为:X:H、Z:O。
(1)X、Z两种元素的元素符号为:X:H、Z:O。
(2)由X、Z、W三种元素形成的化合物的电子式为 。所含化学键类型为共价键。

 (3)由X、Y、Z所形成的常见离子化合物是NH4NO3(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为:NH4++OH- NH3↑+H2O;该化合物的水溶液显酸性,原因是:NH4++H2O NH3·H2O+H+(用离子方程式表示)。
(3)由X、Y、Z所形成的常见离子化合物是NH4NO3(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为:NH4++OH- NH3↑+H2O;该化合物的水溶液显酸性,原因是:NH4++H2O NH3·H2O+H+(用离子方程式表示)。
(4)发射卫星时可用Y2X4作燃料,已知298K时,1gY2X4气体燃料生成无污染的两种气体,放出16.7kJ的热量,试写出该反应的热化学方程式:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.4kJ·mol-1。
[高考模拟]
4、(2007威海模拟)X、Y均为短周期元素,且X为ⅠA族元素,Y为ⅥA族元素,下列说法正确的是( C )
A、X的原子半径一定大于Y的原子半径
B、由X、Y形成的共价化合物中所有原子都满足最外层为8电子结构
C、X2Y既可能是离子化合物,也可能是共价化合物
D、由X、Y组成的化合物中,X、Y的原子个数比不可能是1︰1
5、(2007海口模拟)氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用产生NH3,试回答:
(1)Na3N与水反应的化学方程式是:Na3N+3H2O=3NaOH+NH3↑,该化合物是由离子键形成。
(2)Na3N与盐酸反应生成两种盐,其化学方程式是:Na3N+4HCl=3NaCl+NH4Cl。
(3)比较Na3N中两种微粒的半径大小:r(Na+)<r(N3-)。(填“>”、“=”或“<”)
(一)二者的比较
|
化合物类型 |
定义 |
与物质分类的关系 |
举例 |
|
离子化合物 |
含有离子键的化合物 |
包括强碱、绝大多数盐及活泼金属的氧化物 |
NaCl、NaOH、NH4Cl等 |
|
共价化合物 |
只含有共价键的化合 物 |
包括酸、弱碱、极少数盐、气态氢化物、非 金属氧化物、部分金属氧化物等 |
H2S、SO2、H2SO4、NH3、 H2O等 |
(二)氢键
1、特点:(1)可看成一种较强的分子间作用力;
(2)作用力的强弱:分子间作用力<氢键<化学键;
(3)含氢键的物质某些物理性质反常,如熔、沸点升高,在水中的溶解度增大。
2、形成条件:N、O、F三种原子易和H原子形成氢键。
(一)分子间作用力
1、定义:把分子聚集在一起的作用力,又称范德华力。
2、特点:(1)分子间作用力比化学键弱;
(2)影响物质的熔沸点、溶解性等物理性质;
(3)只存在于由共价键形成的多数共价化合物和绝大多数气态非金属单质以及稀有气体之间,如CO2、H2、He分子间。
3、变化规律:一般来说,对于分子结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质其熔沸点由高到低为:I2>Br2>Cl2>F2。
20. I have recently discovered that _____ is the people you surround yourself with that matters most in life.
A. what B. it C. who D. that
19.--I' m sorry; I shouldn't have been so rude to you.
--You___________ your temper but that's OK
A. did lose B. have lost C. had lost D. were losing
18.________ that saw the rise of quite a number of famous women writers in China, such as Zhang Ailing, Xiao Hong and so on.
A. During the first half of the 20th century
B. That it was in the first half of the 20th century
C. It was in the first half of the 20th century
D. It was the first half of the 20th century
17. No sooner the news than they rushed out into the street.
A. they heard B. they had heard C. did they hear D. had they heard
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com