
8.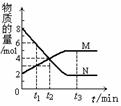 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
A.反应的化学方程式为:2M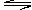 N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率 D.t1时,N的浓度是M浓度的2倍
7.反应速度v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2→2HCl的反应速度v可表示为v=k [c(H2)]m·[c(Cl2)]n。式中k为常数,m、n值可用下表中数据确定之。
|
c(H2)(mol/L) |
c(Cl2)(mol/L) |
v(mol/L·s) |
|
1.0 |
1.0 |
1.0k |
|
2.0 |
1.0 |
2.0k |
|
2.0 |
4.0 |
4.0k |
由此可推得,m、n的值分别为
A.1
1 B.
 C.
C. 1 D.1
1 D.1 
0.4mol/(L·min)
C.OE、EF、FG三段中,该反应用二氧化碳表示
的平均反应速率之比为2∶6∶7
D.G点表示收集到的CO2的量最多
6.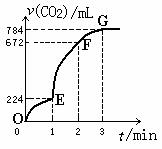 用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是
A.OE段表示的平均速率最快
B.EF段,用盐酸表示该反应的平均反应速率为
5.在一定温度下,向一个2L的真空密闭容器中(预先装入催化剂)通入1molN2和3molH2,经过一段时间后,测得容器内压强是起始时的0.9倍。在此时间内H2的平均反应速率为0.1mol/(L·min),则经过时间为
A.2 min B.3min C.4min . D.5 min
4.下列说法正确的是
A.增大反应物浓度,可增大单位体积内活化分子百分数,从而使有效碰撞次数增大
B.有气体参加的化学反应,若增大压强,可增大活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数
D.催化剂能增大单位体积内活化分子百分数,从而成千成万倍地增大化学反应速率
3.恒容下的反应2SO2+O2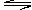 2SO3,ΔH<0。达到平衡后,下列措施可以加快反应速率的是
2SO3,ΔH<0。达到平衡后,下列措施可以加快反应速率的是
A.将SO3分离出一部分 B.充入少量N2,增大压强
C.升温 D.充入少量SO3气体
2.NO和CO都是汽车尾气里有害物质,它们缓慢的起反应生成N2和CO2,对此反应,下列叙述正确的是
A.使用催化剂加快反应速率 B.改变压强对反应速率无影响
C.降低压强能增大反应速率 D.升高温度能加大反应速率
1.在一个容积为2L的密闭容器中,发生3A+B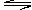 2C 的反应,若最初加入的A和B都是4mol,A的平均反应速率是0.12mol/(L•S),则10 S 后容器中的B是
2C 的反应,若最初加入的A和B都是4mol,A的平均反应速率是0.12mol/(L•S),则10 S 后容器中的B是
A.2.8mol B.1.6mol C.3.2mol D.3.6mol
4.在容积为2L的密闭容器中充入3mol气体A和2.5mol气体B,发生反应:3A(g)+B(g)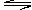 xC(g)+2D(g)。5min以后,测得生成1mol D,C的平均反应速率v(C)=0.1mol/(L·min)。则A的反应速率v(A)= ;此时B的转化率= ;x= 。
xC(g)+2D(g)。5min以后,测得生成1mol D,C的平均反应速率v(C)=0.1mol/(L·min)。则A的反应速率v(A)= ;此时B的转化率= ;x= 。
[课后作业]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com