
17.(10分)现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
X |
最外层电子数是次外层电子数的3倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
第三周期元素的简单离子中半径最小 |
(1)元素X的一种单质在生活中常用作饮水机的消毒剂,该单质的化学式是 ,元素Z的离子结构示意图为 。
(2)元素Y与氢元素形成一种离子YH4+,请写出检验溶液中存在该离子的实验操作、现象和结论 。
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式: 。
(4)元素X与元素Y相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.Y的氢化物可在纯X2 中燃烧生成X的氢化物和Y2
b. X的单质比Y的单质更容易与H2 化合
c.X与Y形成的化合物中Y元素呈正价态
16.(11分)某化学小组欲探究铁的化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是 。
(2)完成下列表格:
可选用试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
|
序号 |
实验内容 |
实验现象 |
离子方程式 |
实验结论 |
|
① |
在FeCl2 溶液中滴入适量氯水 |
溶液由浅绿色变为棕黄色 |
|
Fe2+具有 还原性 |
|
② |
在FeCl2
溶液中加入锌片 |
|
Zn+Fe2+=Zn2++Fe |
|
|
③ |
|
固体溶解,溶液由棕黄色变为蓝绿色 |
|
|
(3)根据以上实验结果判断,下列物质中既有氧化性,又有还原性的有: 。
(填序号)
A.Cl2 B.Na C.Cl- D.NO2
(4)亚铁盐在溶液中易被氧化,实验室中保存亚铁盐溶液时应该 以防止亚铁盐被氧化。
15.(8分)化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的功能。
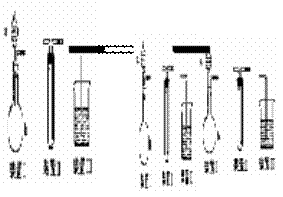
(1)甲同学认为利用该装置可制取和收集NH3、H2,但不能收集CO2,其理由是:______,制取NH3 时,装置Ⅰ的a中的试剂为 ;
(2)乙同学认为装置Ⅰ可作为实验室制氧气的快速发生器,对装置Ⅱ稍作改进后即可作为O2 的收集装置,乙同学对装置Ⅱ的最佳改进方法是:______________________,制O2 时在装置Ⅰ中反应的化学方程式为__________________;
(3)丙同学也将装置Ⅱ改进并用上图整套装置制取、收集SO2 并验证其还原性,则装置 Ⅰ的b中的试剂为 ,验证SO2 的还原性并除去过量SO2 的装置和试剂分别是 、 。
14.有一块铝铁合金,将其溶解于足量盐酸中,再加入过量NaOH溶液,在空气中静置至红褐色沉淀不再增加时,将沉淀滤出再灼烧至恒重,得到残留物的质量与原合金质量相同,则合金中铝的质量分数是
A.22.2% B.30% C.75.5% D.80.6%
青岛市高三教学质量检测
化 学 2009.11
第Ⅱ卷(非选择题 共58分)
13.如图,B为常见金属或非金属单质,有下列转化关系:
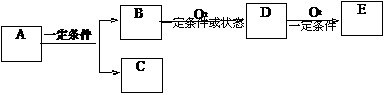
若C是可用作自来水消毒的气体,D、E都是二元化合物(由两种元素组成),D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是
A.NaCl B.H2O2 C.KCl D.AlCl3
12.把SO2 通入Fe(NO3)3 溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若 滴入BaCl2 溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
A.SO2 B.Cl- C.Fe3+ D.NO3 –
11.下列说法中,正确的是
A.所有主族元素正化合价数等于它的族序数
B.VII A族元素的原子随核电荷数的增加,得电子能力逐渐减弱
C.IA、IIA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
D.前三周期元素中共有非金属元素12种
10.对下列各种溶液中所含离子的判断合理的是
A.在pH=13的溶液中可能含:Na+,AlO2-,CO32-,SO32-
B.向无色溶液中加氯水变橙色,溶液中可能含:SO42-,Br-,OH-,Ba2+
C.在常温下加入铝粉有氢气放出,则溶液中可能含:K+,Na+,H+,NO3-
D.使紫色石蕊试液变红色的溶液中可能含:K+,Na+,Ca2+,HCO3-
9.右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的
部分内容。据此,下列说法正确的是
A.该硫酸的物质的量浓度为9.2 mol·L-1 
B. 配制100mL 4.6 mol·L-1 的稀硫酸需取该硫酸25 mL
C.配制100mL 4.6 mol·L-1 的稀硫酸操作的正确顺序为:量取、稀释、移液、冷却、定容
D.该硫酸与等体积的水混合后所得溶液的物质的量浓度等于9.2 mol·L-1
8.下列反应的离子方程式正确的是
A.钠投入水中:Na + H2O = Na+ + OH- + H2↑
B.硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+ = BaSO4↓
C.碳酸钙溶于醋酸:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑
D.硫酸亚铁溶液(酸性)中加入过氧化氢: 4Fe2++ 2H2O2 + 4H+ = 4Fe3+ + 4H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com