
23.(11分)将化学知识的系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
问题1:从不同的角度,化学反应可以有不同的分类方法。四种基本反应类型是从物质的组成和性质进行的分类,氧化还原反应和离子反应则是从其它不同的角度进行分类的。请在下图的方框中,用图示的方法表示离子反应、化合反应、氧化还原反应三者之间的关系。
问题2:氧化还原反应的发生是有条件的。许多条件可以影响氧化还原反应的发生,请用化学反应方程式表示下列观点:反应物相同,反应的条件不同,反应产物不同:
; 。
问题3:化工生产中常用到“三酸两碱”, “三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是 。(填:化学式)
(2)“三酸”与“两碱”之间均可反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式(酸过量时)。
、 。
22.(2分)在某体系内有反应物和生成物6种物质:HCl、Cl2、KCl、KMnO4、MnCl2、H2O。已知HCl为反应物,Cl2为生成物。写出该反应化学方程式(不必配平):
。
21.(14分)某化学小组欲探究氯水的性质,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是
。
试剂:红纸条、AgNO3溶液、氯水、镁粉
实验记录(划斜线部分不必填写):
|
序号 |
实验内容 |
实验现象 |
离子方程式 |
实验结论 |
|
① |
观察新制氯水的颜色 |
新制氯水呈 色。 |
 |
说明溶液中有
分子存在。 |
|
② |
将氯水滴加到红纸条上 |
观察到
。 |
 |
说明溶液中有
分子存在。 |
|
③ |
将氯水滴入AgNO3溶 液中, |
观察到 。 |
|
说明氯水中含有 离子。 |
|
④ |
向氯水中加入镁粉, |
立即有 生成。 |
|
说明氯水中含有 离子。 |
(2)通过以上实验你 (填:“能”或“不能”)确定氯气与水的反应。
写出氯气和水反应的化学方程式 。
20.(5分)(1)下列有关实验的叙述中,正确的是 (填序号)。
①用透析的手段净化尿毒症患者的血液。
②实验室中用水吸收多余的氯气,以防止污染环境
③配制一定物质的量浓度的NaCl溶液时,定容后摇匀,发现液面又低于刻度线,此时应再加入蒸馏水至刻度。
④用小刀切取少量金属钠做实验,切剩的钠要立即放入原试剂瓶。
⑤将金属钠放入硫酸铜溶液中可以置换出铜
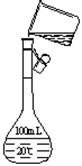 ⑥向100℃时的NaOH稀溶液中滴加饱和的FeCl3溶液,以制备Fe(OH)3胶体;
⑥向100℃时的NaOH稀溶液中滴加饱和的FeCl3溶液,以制备Fe(OH)3胶体;
(2)请按要求填空:
①某同学用已准确称量的NaCl晶体配制0.100 mol·L-1NaCl
溶液200 mL,所需的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还
缺少的一种玻璃仪器是 。
②右图是该同学配制上述溶液时,转移溶液的示意图,图中
的错误是:
。
19. 有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(NaCl)/mol·L-1为
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
 厦门六中2009-2010学年度第一学期高一期中考试
厦门六中2009-2010学年度第一学期高一期中考试
化 学 试 题
第Ⅱ卷(非选择题 共54分)
18.从下列事实所列出的相应结论正确的是
|
|
实 验 事 实 |
结 论 |
|
① |
Cl2的水溶液可以导电 |
Cl2是电解质 |
|
② |
将约绿豆大小的钠投入装有适量水的烧杯中,观察到,钠立刻熔化成一个闪亮的小球。 |
钠比水轻;钠的熔点较低。 |
|
③ |
Na2O2与水或CO2反应产生O2 |
Na2O2可作供氧剂 |
|
④ |
某溶液中先加入AgNO3溶液有白色沉淀产生,再加稀硝酸,沉淀不消失 |
该溶液一定有Cl- |
|
⑤ |
某溶液中先加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失 |
该溶液一定有SO42- |
A.③④⑤ B.②③④ C.①②③ D.②③⑤
16. 下列叙述不正确的是
A.NaCl的摩尔质量是58.5g/mol
B.将wg a%的NaCl溶液蒸发掉 g水,得到2a%的NaCl溶液
g水,得到2a%的NaCl溶液
C.将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1mol/L
D.将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液
|
A.2H2O == H2↑ + O2↑ B.2F2 + 2H2O = 4HF + O2
C.Na2O+H2O = 2NaOH D.2Na+H2O = 2NaOH+H2↑
15.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等;
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应;
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
④根据在水溶液中或熔化状态下能否导电将化合物分为电解质和非电解质。
⑤根据氧化物的组成将所有氧化物分为碱性、两性和酸性氧化物
A.①③ B.②④ C.①②④ D.②③④⑤
14.下列各组离子能大量共存于同一水溶液中的是
A.HCO3- 、Na+、K+、H+ B.NO3-、Ca2+-、Na+、CO32-
C.Mg2+、K+、NO3-、OH- D.Cu2+、H+、Na+、Cl-
13.用NA表示阿伏加德罗常数的值,下列叙述正确的是 A.标准状况下,22.4 L氦气所含原子数为2 NA
B.2L 0.3mol/L K2SO4溶液中含K+的物质的量浓度为1.2mol/L
C.NA个硫酸分子的质量是98 g/mol
D.将2.3 g钠放入足量的水中完全反应转移的电子数为0.1NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com