
31.(12分)为了预防碘缺乏病,国家规定每1000g食盐中应含有40 mg~50 mg的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428 g,设法溶解出其中全部的碘酸钾。将溶液用足量的稀硫酸酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030 mol/L的Na2S2O3溶液滴定,用去18.00 mL时蓝色刚好褪去。
(1)配平有关反应方程式①:
①IO3- + I- + H+ → I2 + H2O
②I2 + 2 S2O32- == 2I-+ S4O62-
(2)为了提高实验的准确性,需要用纯净的食盐水来代替食盐样品做对比实验,这是因为滴定过程中会发生空气氧化碘化钾的副反应。写出副反应的离子方程式:_______________________
副反应对实验测量食盐中碘酸钾含量结论的影响是( )
A.偏大 B.偏小 C.无影响 D.无法确定
(3)若不计副反应的影响,试通过计算说明该加碘食盐是否为合格产品?
长泰一中2009-2010学年第一学期期中考试
30.(12分)A、B、C、D均为中学化学常见的物质,其组成元素均为主族元素。它们间的反应关系如下图所示。(除⑵外,反应均在常温下进行)
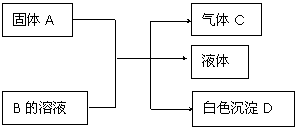
⑴若A为金属钠,B为饱和NaOH溶液,则白色沉淀D为 (写化学式)
⑵若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则A与B反应(可加热)的化学方程式为 。
⑶若A是碳化钙(CaC2),B是一种盐,A与B的溶液反应时只生成气体C、CaCO3和水;则B的化学式为 ;若C的燃烧热为1300kJ·mol-1,则C燃烧的热化学方程式为 。
⑷若B是正盐,D既可溶于盐酸又可溶于NaOH溶液,A的相对分子质量与D相同,向一定量的B溶液中逐渐加入固体粉末A,当 A与B以物质的量之比3∶1反应时,生成的D的量最多。推知A的化学式为 , B的化学式为 。
29.(12分)有机物A、B、C、D、E、F、G相互关系如下图所示。5.2g F能与100mL 1mol·L-1 NaOH溶液恰好完全中和,0.1mol F还能与足量金属钠反应,在标准状况下放出2.24L H2。D的分子式为C3H3O2Na,E的分子中含有羧基。
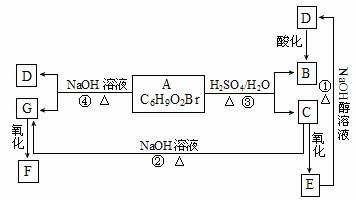
(1)写出下列物质的结构简式:G ;F 。
(2)化学反应类型:① ;④ 。
(3)化学方程式:① ;③ 。
27.(8分)(1)现学生实验需要用480ml 0.1mol·L-1碳酸钠溶液。则应用托盘天平称取十水合碳酸钠晶体(Na2CO3·10H2O) g进行配Na2CO3溶液。
(2)配制碳酸钠溶液时需要用到的仪器有 。
(3)下列操作会使溶液物质的量浓度偏低的是 。
A.没有将洗涤液转移到容量瓶中 B.容量瓶洗净后未经干燥处理
C.转移过程中有少量溶液溅出 D.加水时,水的量超过了刻度线
E.摇匀后立即观察,发现溶液未达到刻度线,再用滴管加几滴蒸馏水至刻度线
28(12分)用下图所示装置进行实验,将A逐滴加入B中:
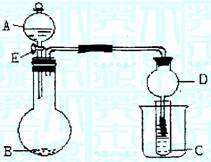
(1)若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是 。然后往烧杯中加入沸水,可观察到试管C中的现象是 。
(2)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则
A是 (写名称),C是 (写化学式)与乙醛的混合液。该反应的化学方程式为 ,仪器D在此实验中的作用是 。
26.( 8分)(1)反应3BrF3+5H2O==HBrO3+Br2+9HF+O2↑中,氧化剂是____________,氧化产物是_______,每生成标准状况下11.2LO2,则整个反应中转移电子的物质的量是____________mol。
(2)通过焰色反应,并透过蓝色钴玻璃可以观察到钾元素的焰色为
25.(14分)
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是______.
(2)“三酸”与“两碱”之间均可反应,若用化学方程式表示有六个(酸过量时),若用离子方程式表示却只有两个,请写出这两个离子方程式(酸过量时)。_________________
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是__________。
A.Ag B.Cu C.Al D.Fe
(4)烧碱、纯碱均可吸收 ,当含0.1mol
,当含0.1mol 的溶液吸收一定量
的溶液吸收一定量 后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:
后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:
①______________② ③______________④
③______________④
将得到的固体重新溶解于水,在溶液中加盐酸,使溶液的PH=7,再将溶液蒸干,得到固体的质量是______g。
24、下列各组溶液中,不用其他试剂无法将他们区别开来的是
A.HCl、Na2CO3、Mg(NO3)2、NaOH B.NaCl、AgNO3、CaCl2、Na2CO3
C.NaOH、CuSO4、MgSO4、HCl D.NaOH、AlCl3、MgSO4、HCl
第Ⅱ卷(非选择题 共78分)
23、若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有18O的物质有:
A 1种 B 2种 C 3种 D 4种
22.苯酚和苯甲醇共同的化学性质是
A 有酸性 B 与钠反应放出氢气
C 遇三氯化铁溶液显紫 D 与氢氧化钠溶液反应
21. 糖类、油脂、蛋白质是人类重要的营养物质。下列说法正确的是
A.葡萄糖不能跟新制的氢氧化铜反应生成红色沉淀
B.油脂在碱性条件下水解生成甘油和高级脂肪酸
C.蛋白质水解的最终产物是氨基酸
D.欲将蛋白质从水中析出而又不改变它的性质,应加入CuSO4溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com