
1.“陈胡公滿者,虞帝舜之后也。……周武王克殷,……封之于陈。”胡滿属于西周时受封的
A.王族 B.功臣 C .先代贵族 D.周边归顺贵部落首领
9. 答案:(1)Na>Al>O;(2)HNO3>H2CO3>H2SiO3;(3)
(4)ab;
答案:(1)Na>Al>O;(2)HNO3>H2CO3>H2SiO3;(3)
(4)ab;
(5)Al3+ +3NH3 ·H2O=Al(OH)3
↓+3NH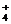 ;2Al2O3
4Al+3O2 ↑;中性。
;2Al2O3
4Al+3O2 ↑;中性。
解析:根据周期数等于电子层数,主族序数等于最外层电子数,结合核外电子的排布规律,判断得出①~⑧号元素依次为:H 、C 、N 、 Na 、Al 、Si 、Cl。
(1)根据元素所在的位置关系,原子半径规律:左下角大于右上角,⑤>⑥>④,即Na>Al>O。
(2)同主族元素原子序数越小;非金属性越强,非金属性:②>⑦,同周期元素,原子序数越大,非金属性越强,非金属性:③>②,非金属性越强,对应的非金属最高价氧化物的水化物的酸性越强,最高价含氧酸的酸性由强到弱的顺序是③>②>⑦,即HNO3>H2CO3>H2SiO3 。
(3)含离子键的化合物必须含有阴阳离子,阳离子通常是金属阳离子或铵根离子,①、④、⑤、⑧中没有氮元素,该化合物中一定含有钠元素,含极性键的化合物必须含有两种不同的非金属元素,氢、氧、氯三种元素形成的阴离子有:OH- 、ClO- 、ClO 、ClO
、ClO 、ClO
、ClO ,其中前两种是最常见的阴离子,①、④、⑤、⑧形成的既含离子键又含极性共价键的化合物的电子式为:
,其中前两种是最常见的阴离子,①、④、⑤、⑧形成的既含离子键又含极性共价键的化合物的电子式为:
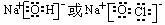 (4)由表中两种元素的原子按1:1组成的常见液态化合物是过氧化氢,过氧化氢的稀液易被催化分解,可使用的催化剂为二氧化锰和氯化铁溶液,Na2SO3具有还原性,被双氧水氧化,不能做催化剂;KMnO4
(4)由表中两种元素的原子按1:1组成的常见液态化合物是过氧化氢,过氧化氢的稀液易被催化分解,可使用的催化剂为二氧化锰和氯化铁溶液,Na2SO3具有还原性,被双氧水氧化,不能做催化剂;KMnO4
具有强氧化性,氧化双氧水产生氧气,不能做催化剂,因为催化剂是改变化学反应速率而本身的质量和性质都不改变的一类物质。
 (5)⑥的单质是铝,铝只能由电解氧化铝制得,拟推氧化铝由氢氧化铝受热分解制得,氢氧化铝由复分解反应制得,M是仅含非金属元素的盐,一定是铵盐,拟推法X+Y→Al(OH)3
+NH
(5)⑥的单质是铝,铝只能由电解氧化铝制得,拟推氧化铝由氢氧化铝受热分解制得,氢氧化铝由复分解反应制得,M是仅含非金属元素的盐,一定是铵盐,拟推法X+Y→Al(OH)3
+NH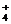 ;X和Y一种是氨水一种是可溶性铝盐,根据:常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至中性,得知Y是氨水,X是可溶性铝盐,氯化铝或硝酸铝,不可能是碳酸铝或硅酸铝,因为弱酸弱碱盐强烈水解不存在。X溶液与Y溶液反应的离子方程式为:Al3+
+3NH3 ·H2O=Al(OH)3 ↓+3NH
;X和Y一种是氨水一种是可溶性铝盐,根据:常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至中性,得知Y是氨水,X是可溶性铝盐,氯化铝或硝酸铝,不可能是碳酸铝或硅酸铝,因为弱酸弱碱盐强烈水解不存在。X溶液与Y溶液反应的离子方程式为:Al3+
+3NH3 ·H2O=Al(OH)3 ↓+3NH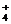 ;N→⑥的单质的化学方程式为:2Al2O3
4Al+3O2 ↑; M 溶液中由M电离的阴、阳离子浓度相等,根据电荷守恒,氢离子浓度和氢氧根浓度也一定相等,M 溶液是强酸弱碱盐,水解呈酸性,为了使溶液呈中性,一定是加入了过量的氨水。
;N→⑥的单质的化学方程式为:2Al2O3
4Al+3O2 ↑; M 溶液中由M电离的阴、阳离子浓度相等,根据电荷守恒,氢离子浓度和氢氧根浓度也一定相等,M 溶液是强酸弱碱盐,水解呈酸性,为了使溶液呈中性,一定是加入了过量的氨水。
要点1:原子半径比较规律:按元素周期表中元素的位置关系判断:同行(同周期)左>右;同列(同主族)下>上;综上:左下>右上。
要点2:非金属性判断:按元素周期表中元素的位置关系判断:同行(同周期)右>左;同列(同主族)上>下;综上:右上>左下。非金属性越强,其对应的最高价氧化物的水化物的酸性越强。
要点3:含离子键的化合物必定含有金属阳离子或铵根离子中的一种,含极性键的离子化合物如果阳离子是金属阳离子,阴离子必定由有两种不同的非金属元素组成,如果阳离子是铵根离子,阴离子可以是一种元素组成的单核阴离子。
 要点4:离子化合物的电子式书写注意事项:①要标明电荷符号,②复杂的阴阳离子要用中括号括起来,③金属阳离子的电子式是离子符号本身,阴离子的电子式除了氢原子外,都应该满足8电子稳定结构,④在多离子化合物中,注意阴阳离子间要交替排列,在此基础上,还要注意微调离子内部元素、正负价元素交替排列,例如:
要点4:离子化合物的电子式书写注意事项:①要标明电荷符号,②复杂的阴阳离子要用中括号括起来,③金属阳离子的电子式是离子符号本身,阴离子的电子式除了氢原子外,都应该满足8电子稳定结构,④在多离子化合物中,注意阴阳离子间要交替排列,在此基础上,还要注意微调离子内部元素、正负价元素交替排列,例如:
要点5:电解法冶炼铝是突破口,不含金属只含非金属的盐是铵盐也是解题突破口。
要点6:不溶性碱受热分解得到氧化物。
要点7:制备氢氧化铝的方法是用可溶性铝盐和氨水反应的方法。
要点8:根据电荷守恒式判断离子浓度之间的关系,例如:只含有氯离子、铵根离子、氢离子、氢氧根离子的溶液,如果氯离子和铵根离子浓度相等,根据电荷守恒,溶液一定呈中性。
9.(天津理综第7题 14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:

(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_________________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
 (5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为_____________________,
N→⑥的单质的化学方程式为______________ _。
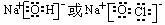 常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_________________。
8. 答案:(1).原子晶体;(2).NO2 、N2O4
;(3).As2S5
;(4).①.NH3>AsH3>PH3
,NH3分子间存在氢键,使得分子间结合力增大,沸点反常地高,AsH3和PH3
是结构相似的分子晶体,相对分子质量越大,分子间作用力越大,沸点越高,AsH3>PH3,总顺序为:NH3>AsH3>PH3
;②.SiH4 、正四面体结构,PH3
、三角锥形,H2S、角形或V形。(5).SiCl4+4NH3
答案:(1).原子晶体;(2).NO2 、N2O4
;(3).As2S5
;(4).①.NH3>AsH3>PH3
,NH3分子间存在氢键,使得分子间结合力增大,沸点反常地高,AsH3和PH3
是结构相似的分子晶体,相对分子质量越大,分子间作用力越大,沸点越高,AsH3>PH3,总顺序为:NH3>AsH3>PH3
;②.SiH4 、正四面体结构,PH3
、三角锥形,H2S、角形或V形。(5).SiCl4+4NH3 Si(NH2)4+4HCl 3Si(NH2)4
Si(NH2)4+4HCl 3Si(NH2)4 8NH3+Si3N4
8NH3+Si3N4
解析:元素Q、R、W、Y与元素X相邻,相互间的位置关系如右: ,Y的最高化合价氧化物的水化
物是强酸,Y是N 、S 、Cl三种元素之一。W的氯化物分子呈正四面体结构,W位于元素周期表的IVA, Q的具有相同化合价且可以相互转变的氧化物中学阶段只有NO2 、N2O4 ,Q是N元素,C和N元素不可能形成高温结构陶瓷,根据教材中新型材料的介绍有Si3N4高温结构陶瓷,确定W是硅元素,根据位置关系,X是P元素,X的下方元素是As元素,X的右方元素是S元素;P 和As元素的最高价氧化物对应的水化物都不是强酸,Y是S 元素,所以R是As元素。
要点1:IVA~VIIA元素最低价氢化物的空间结构类型、氧化物类型是高考时的热点。
要点2:NH3 、H2O 、HF的沸点比同族非金属氢化物的沸点反常的高,是因为它们分子间能形成氢键分子键作用力明显增大的缘故。
8.(全国I理综第29题 15分)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1).W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是 ;
(2).Q的具有相同化合价且可以相互转变的氧化物是 ;
(3).R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 ;
(4).这5个元素的氢化物分子中,①.立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是 ;
②.电子总数相同的氢化物的化学式和立体结构分别是
(5).W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物 和
和 气体;
气体; 在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
7. 答案:B
答案:B
 详解:处于元素周期表金属与非金属分界线附近的元素,既表现金属性,又表现非金属性,例如铝和硅,A错误;主族元素的最高正化合价等于它所处的主族序数,也等于其最外层电子数,B正确;H+的最外层电子是0,C项错误;同一主族的元素的原子,例如:氢元素和钠元素,氢元素有氧化性,钠元素只有还原性,D错误。
详解:处于元素周期表金属与非金属分界线附近的元素,既表现金属性,又表现非金属性,例如铝和硅,A错误;主族元素的最高正化合价等于它所处的主族序数,也等于其最外层电子数,B正确;H+的最外层电子是0,C项错误;同一主族的元素的原子,例如:氢元素和钠元素,氢元素有氧化性,钠元素只有还原性,D错误。


 要点1:铝元素的非金属性,Al(OH)3呈弱酸性:NaAlO2+2H2O+CO2=NaHCO3+Al(OH)3 ↓
要点1:铝元素的非金属性,Al(OH)3呈弱酸性:NaAlO2+2H2O+CO2=NaHCO3+Al(OH)3 ↓
要点2:硅的金属性:有金属光泽,和某些酸反应产生氢气:Si+4HF=SiF4 ↑+2H2 ↑
7. (山东理综第11题 4分)
(山东理综第11题 4分) 元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
A.同一元素不可能既表现金属性,又表现非金属性
 B.第三周期元素的最高正化合价等于它所处的主族序数
B.第三周期元素的最高正化合价等于它所处的主族序数
 C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
 D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
6. 答案:D
答案:D

 详解:X、Y、Z相邻且X的原子序数为Y的一半,推测X为氧元素,Y为硫元素,X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大Z为氯元素,Y与M可形成化合物M2Y,M为钾元素。X、Y、Z单质的氧化性顺序为O2 、Cl2 、S,H2S的还原性最强,A错误;简单离子半径:S2-(Y)>Cl-(Z)>K+(M),B错误;SO2为极性分子,而K2S属于离子化合物,C错误;Z元素的最高价氧化物的水化物的化学式为HZO4 ,D正确。
详解:X、Y、Z相邻且X的原子序数为Y的一半,推测X为氧元素,Y为硫元素,X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大Z为氯元素,Y与M可形成化合物M2Y,M为钾元素。X、Y、Z单质的氧化性顺序为O2 、Cl2 、S,H2S的还原性最强,A错误;简单离子半径:S2-(Y)>Cl-(Z)>K+(M),B错误;SO2为极性分子,而K2S属于离子化合物,C错误;Z元素的最高价氧化物的水化物的化学式为HZO4 ,D正确。
要点:非金属性越强对应的氢化物越稳定。
6. (四川理综第10题 6分)X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是
(四川理综第10题 6分)X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是
A.
 还原性:X的氢化物>Y的氢化物>Z的氢化物
还原性:X的氢化物>Y的氢化物>Z的氢化物
B.
 简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C.
 YX2、M2Y都是含有极性键的极性分子
YX2、M2Y都是含有极性键的极性分子
D.
 Z元素的最高价氧化物的水化物的化学式为HZO4
Z元素的最高价氧化物的水化物的化学式为HZO4
5.答案:D
解析:甲分子中含18个电子,甲是气态氢化物,在水中分步电离出两种阴离子,甲是H2S。某钠盐溶液含甲电离出的阴离子,该阴离子可以是S2-、HS-,该溶液是强碱弱酸盐水解显碱性,其中NaHS既能与酸反应又能与碱反应 ,A错误;乙与氧气的摩尔质量相同,与氧气的摩尔质量相同的分子有SiH4 、N2H4 、CH3OH,其中N2H4中含有极性键和非极性键
,A错误;乙与氧气的摩尔质量相同,与氧气的摩尔质量相同的分子有SiH4 、N2H4 、CH3OH,其中N2H4中含有极性键和非极性键 ,而SiH4 和CH3OH分子中只含有极性键,B错误;丙中含有第二周期IVA族(碳)的元素,含有碳元素的18电子的化合物有CH3F、CH3OH、CH3NH2 、C2H6 ,只有C2H6是甲烷的同系物,C错误;丁和甲中各元素质量比相同,则丁是H2O2,分子中一定含有-1价的元素,D正确。学科
,而SiH4 和CH3OH分子中只含有极性键,B错误;丙中含有第二周期IVA族(碳)的元素,含有碳元素的18电子的化合物有CH3F、CH3OH、CH3NH2 、C2H6 ,只有C2H6是甲烷的同系物,C错误;丁和甲中各元素质量比相同,则丁是H2O2,分子中一定含有-1价的元素,D正确。学科
要点1:含18电子的非金属气态氢化物:HCl (直线形)、H2S (角形)、PH3 (三角锥形)、SiH4 (正四面体)。
要点2:含18电子的9电子微粒偶合体:F-F 、HO-OH 、H2N-NH2 、H3C-CH3 。
要点3:含18电子的9电子微粒杂合体:H3C- F (一氟代甲烷)、H3C- OH(甲醇) 、 H3C- NH2(甲胺)。
要点4:含18电子的相对分子质量相同的微粒:
|
相对分子质量 |
34 |
32 |
|
分子式 |
H2S
、PH3
、H2O2
、CH3F |
SiH4
、N2H4
、CH3OH |
要点5:含18电子的氧化性微粒:F2 、H2O2 ,含18电子的还原性微粒:HCl 、H2S 、PH3 、SiH4 、N2H4、C2H6 、CH3OH(甲醇)、CH3NH2(甲胺) 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com