
3.⑴ 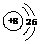 ⑵ HF>HCl ⑶ NaF>NaCl
⑵ HF>HCl ⑶ NaF>NaCl
⑷ H2(g)+Cl2(g)=2HCl(g);ΔH=-184.6kJ·mol-1
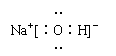 当堂反馈:1.A 2.B 3.⑴ H2O 在H2O分子之间存在着氢键的作用
当堂反馈:1.A 2.B 3.⑴ H2O 在H2O分子之间存在着氢键的作用
⑵ H++HSO3-=H2O+SO2↑ ⑶ ⑷ 阴 2Cl――2e-=Cl2↑ 湿润的碘化钾淀粉试纸 4. A 5. ①Br、Mg、Al、S ②Mg>Al>S ③H2S+Br2=S↓+2HBr
课后练习:1.D 2.A 3.C 4.AD 5.B 6.D 7.A 8.C 9.AB 10.B
14.A、B、C、D为周期表中前三周期元素,A元素原子的次外层电子数是最外层电子数的二分之一,B的阴离子核外只有一个电子层、C单质在标准状况下密度是1.43g/L,D元素的焰色反应呈黄色。将以上四种元素组成的结晶盐3.4g加热反至完全失去结晶水,其质量减少1.35g,所得无水盐中C元素的质量分数为39%,将该无水盐与适量盐酸作用得到一种弱酸,再将所得弱酸完全燃烧可得0.9g水和1.12L标准状况下的CO2,已知这种弱酸的一个分子中共有32个质子。试回答:①A、B、C、D四种元素各是什么元素?②求结晶盐化学式。
第十二讲
例题:1.AD 2.D[既要考虑普遍性(第IIA族和第ⅦA族、第ⅣA族和第ⅥA族之间形成的化合物),又要考虑特殊性(具有可变价元素之间形成的化合物)。对应的物质可以分别为CO2、BeF2、CS2、BeCl2、MgF2 、MgC2、SO2、NO2]
13.已知X、Y、Z、W是短周期四种非金属元素,它们的原子序数依次增大。X元素原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。这四种元素可以组成原子个数比为5∶1∶1∶3的化合物(按X、Y、Z、W的顺序),则该化合物的水溶液与足量的NaOH溶液反应的离子方程式为 。
12.1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,并通过热化学方法建立了其他元素的电负性。Linus Pauling建立的主族元素的电负性如下:
|
H:2.1 |
|
|
|
|
|
|
|
Li:1.0 |
Be:1.5 |
B:2.0 |
C:2.5 |
N:3.0 |
O:3.5 |
F:4.0 |
|
Na:0.9 |
Mg:1.2 |
Al:1.5 |
Si:1.8 |
P:2.1 |
S:2.5 |
Cl:3.0 |
|
K:0.8 |
Ca:1.0 |
Ga:1.6 |
Ge:1.8 |
As:2.0 |
Se:2.4 |
Br:2.8 |
|
Rb:0.8 |
Sr:1.0 |
In:1.7 |
Sn:1.8 |
Sb:1.9 |
Te:χ |
I:2.5 |
|
Cs:0.7 |
Ba:0.9 |
Tl:1.8 |
Pb:1.9 |
Bi:1.9 |
Po:2.0 |
At:2.2 |
|
Fr:0.7 |
Ra:0.9 |
|
|
|
|
|
回答下列问题:⑴ 写出上述元素电负性在同周期或同主族中的递变规律(任定一种): ;⑵ 预测Te元素χ的值 ,它的非金属性比I元素 (填“强”或“弱”);⑶ 你认为Linus Pauling提出电负性的概念是确定化合物中原子 (填“失电子”、“得电子”)能力的相对大小。⑷ 大量事实表明,当两种元素的χ值相差大于或等于1.7时,形成的化合物一般是离子化合物,根据此经验规律, AlCl3中的化学键类型应该是 。
11.右表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
⑴下列 (填写编号)组元素的单质可能都是电的良导体。①a、c、h ②b、g、k ③c、h、1 ④d、e、f
⑵如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:i.原子核对核外电子的吸引力;ii.形成稳定结构的倾向。右表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7296 |
4570 |
1820 |
|
失去第三个电子 |
11799 |
6920 |
2750 |
|
失去第四个电子 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 。
②表中X可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成化合物的化学式 。③Y是周期表中 族元素。④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
10.两种短周期元素组成的化合物中,原子个数比为1∶3。若两种元素的原子序数分别为a和b,则a和b的关系可能为:① a=b+5 ② a+b=8 ③ a+b=30 ④ a=b+17
 A.②③
B.①②③
C.②③④
D.①②③④
A.②③
B.①②③
C.②③④
D.①②③④
9.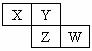 X、Y、Z、W均为短周期元素,它们在周期表中的位置如右图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中不正确的是:
X、Y、Z、W均为短周期元素,它们在周期表中的位置如右图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中不正确的是:
A.原子半径:W>Z>Y>X
B.最高价氧化物对应的水化物的酸性:Z>W>X
C.等物质的量浓度的气态氢化物水溶液的pH:X>Z>W
D.四种元素的单质中,Z单质的熔、沸点最高
8.在周期表中金属和非金属的分界线附近能找到
A.制农药的元素 B.制催化剂的元素
C.做半导体的元素 D.制耐高温合金材料的元素
7.铝和镓的性质相似,如M(OH)3都是难溶的两性氢氧化物。在自然界镓常以极少量分散于铝矿如Al2O3中,用NaOH溶液处理铝矿(Al2O3)时,生成NaAlO2、NaGaO2。而后通入适量的CO2得Al(OH)3沉淀,而NaGaO2留在溶液中(循环多次后成为提取镓的原料)。发生后一步反应是因为
A.镓酸酸性强于铝酸 B.铝酸酸性强于镓酸
C.镓酸浓度不大,所以不沉淀 D.Al(OH)3是难溶物
6.VCD光盘上的记录材料有很多种,它们都可以在激光的照射下发生化学或物理的性能改变而记录、储存信号。碲的某种化合物是常用的VCD光盘记录材料之一,以下对碲元素及其化合物的认识中不正确的是
A.单质碲在常温下是固体 B.H2TeO4的酸性比H2SO4的酸性弱
C.H2Te不如HI稳定 D.碲元素位于周期表中第六周期ⅥA族
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com