
4. 秦始皇在全国范围内推行郡县制度,郡守和县令的产生方式是
A.世代相袭 B.考试选拔 C.皇帝任命 D.地方推荐
3. 根据西周的分封制,诸侯必须①定期向周天子朝贡②随同周天子作战③服从周天子命令④按田亩向周天子纳税
A.①②③ B.①②④ C.①③④ D.①②③④
2.《说文解字》解释说:“宗,尊祖庙也。”也就是说,宗法的“宗”的本义是宗庙。这说明我国宗法制纽带是
A.财产 B.地域 C.信仰 D.血缘
1. 史书记载,结束了三国分裂局面的晋武帝司马炎共有儿子26人,但太子司马衷却天生痴愚。晋武帝想要废太子,另择继承人,皇后劝说:“立嫡以长不以贤,岂可动乎!”于是晋武帝没有更换太子的人选。由此可见,晋武帝选太子是根据
A.世袭制的父死子继原则 B.宗法制的嫡长子继承原则
C.君主制的集权独裁原则 D.禅让制的尚贤原则
37.(16分)如图所示,在绝缘水平面上,相距为L的A、B两点处分别固定着两个等量正电荷。a、b是AB连线上两点,其中Aa=Bb= ,O为AB连线的中点。一质量为m带电量为+q的小滑块(可视为质点)以初动能E0从a点出发,沿AB直线向b运动,其中小滑块第一次经过O点时的动能为初动能的n倍(n>1),到达b点时动能恰好为零,小滑块最终停在O点,求:
,O为AB连线的中点。一质量为m带电量为+q的小滑块(可视为质点)以初动能E0从a点出发,沿AB直线向b运动,其中小滑块第一次经过O点时的动能为初动能的n倍(n>1),到达b点时动能恰好为零,小滑块最终停在O点,求:
(1)小滑块与水平面间的动摩擦因数μ。
(2)Ob两点间的电势差UOb。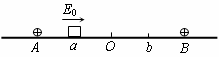
(3)小滑块运动的总路程s。
34.(8分)用如图所示的实验装置验证机械能守恒定律.实验所用的电源为学生电源,输出电压为6V的交流电和直流电两种.重锤从高处由静止开始下落,重锤上拖着
的纸带打出一系列的点,对纸带上的点痕进行测量,即验证机械能守恒定律.
(1)下面列举了该实验的几个操作步骤:
A.按照图示的装置安装器件;
B.将打点计时器接到电源的“直流输出”上;
C.用天平测出重锤的质量;
D.释放悬挂纸带的夹子,同时接通电源开关打出一条纸带;
E.测量纸带上某些点间的距离;
F.根据测量的结果计算重锤下落过程中减少的重力势能是否
等于增加的动能.
其中没有必要进行的或者操作不当的步骤是 .
(将其选项对应的字母填在横线处)
(2)利用以上装置,在“验证机械能守恒定律”的实验中,打点计时器接在电压为U,频率为f的交流电源上,从 实验中打出的几条纸带中选出一条理想纸带,如图所示,选取纸带上打出的连续5个点A、B、C、D、E,测出A点距起始点的距离为S0,点AC间的距离 为S1,点CE间的距离为
为S1,点CE间的距离为 ,已知重锤的质量为m,当地的重力加速度为g,则:
,已知重锤的质量为m,当地的重力加速度为g,则:
①起始点O到打下C点的过程中,重锤重力势能的减少量为△EP= ,重锤动能的增加量为△EK= 。
②根据题中提供的条件,还可利用重锤下落求出当地的重力加速度g= ,经过计算可知,测量值比当地重力加速度的真实值要小,其主要原因是: 。
35(10分).利用如图所示的电路测定电源的电动势和内电阻,提供的器材为:
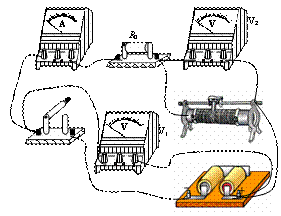 (A)干电池两节,每节电池的电动势约为1.5V,内阻未知
(A)干电池两节,每节电池的电动势约为1.5V,内阻未知
(B)直流电压表V1、V2,内阻很大
(C)直流电流表A,内阻可忽略不计
(D)定值电阻R0,阻值未知,但不小于5W
(E)滑动变阻器
(F)导线和开关
(1)甲同学利用该电路完成实验时,由于某根导线发生断路故障,因此只记录了一个电压表和电流表的示数,如下表所示:
|
U/V |
2.62 |
2.48 |
2.34 |
2.20 |
2.06 |
1.92 |
|
I/A |
0.08 |
0.12 |
0.19 |
0.20 |
0.24 |
0.28 |
 试利用表格中的数据作出U-I图,由图像可知,该同学测得两节干电池总的电动势值为__________V,总内阻为__________W。由计算得到的数据可以判断能够正确示数的电压表应为表__________(选填“V1”或“V2”)
试利用表格中的数据作出U-I图,由图像可知,该同学测得两节干电池总的电动势值为__________V,总内阻为__________W。由计算得到的数据可以判断能够正确示数的电压表应为表__________(选填“V1”或“V2”)
(2)乙同学在找出断路的导线并调换好的导线后,连接该电路继续实验时,由于电流表发生短路故障,因此只能记下两个电压表的示数,该同学利用表中的数据,以表V1的示数U1为横坐标、表V2的示数U2为纵坐标作图像,也得到一条不过原点的直线,已知直线的斜率为k,截距为b,则两节干电池总的电动势大小为__________,两节干电池的总内阻为__________(选填“可以”或“不可以”)求出。
如果该同学希望通过利用图像的截距直接得到电源的电动势,保持为纵坐标不变,应该选用__________作为横坐标作图。
36(1)(10分)一个物体在地面上受到的重力为160N,将它放置在航天飞机中,当航天飞机以加速度a=5m/s2随火箭竖直向上加速升空的过程中,某时刻测得物体与航天飞机中的支持物在竖直向上的相互挤压力为90N,(地球的半径 ,g=10m/s2)求此时
,g=10m/s2)求此时
①航天飞机所在高度的重力加速度
②航天飞机距离地面的高度。
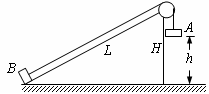
(2).(10分)如图所示,光滑斜面的长为L=1 m、高为H=0.6 m,质量分别为mA和mB的A、B两小物体用跨过斜面顶端光滑小滑轮的细绳相连,开始时A物体离地高为h=0.5 m,B物体恰在斜面底端,静止起释放它们,B物体滑到斜面顶端时速度恰好减为零,求A、B两物体的质量比mA︰mB。
某同学解答如下:对A、B两物体的整个运动过程,由系统机械能守恒定律得mAgh―mBgH=0,可求得两物体的质量之比……。
你认为该同学的解答是否正确,如果正确,请解出最后结果;如果不正确,请说明理由,并作出正确解答。
33.(15分)明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:

根据上述图示,完成下列填空:
⑴明矾石焙烧后用稀氨水浸出。配制500 mL稀氨水(每升含有39.20 g氨)需要取浓氨水(每升含有251.28 g氨),用规格为______mL量筒量取。
⑵氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。
检验NH4+的方法是______________________________。
⑶写出沉淀物中所有物质的化学式_____________________。
⑷滤液I的成分是水和________________。
⑸为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量________溶液,产生白色沉淀。
②____ ___、_______、_______(依次填写实验操作名称)。
③冷却、称重。
⑹若试样为m g,沉淀的物质的量为 n mol,则试样中K2SO4的物质的量为:_ ___ mol(用含m、n的代数式表示)。
32.(16分)向一体积不变的密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如附图一所示。附图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。

(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2)t4-t5阶段改变的条件为 ,B的起始物质的量为 。各阶段平衡时对应的平衡常数如下表所示:
|
t1-t2 |
t2-t3 |
t3-t4 |
t4-t5 |
t5-t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1= (保留两位小数),K1、K2、K3、K4、K5之间的关系为 (用“>”、“<”或“=”连接)
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为akJ,写出此温度下该反应的热化学方程式
。
(4)在相同条件下,若起始时容器中加入a molA、bmolB和cmolC,要达到t1时刻同样的平衡,a、b、c要满足的条件为 、 。(用含a、c和 b、c 两个方程式表示)
31.(20分)某课外活动小组同学用右图装置进行实验,试回答下列问题。
(1)若开始时开关K与a连接,则B极的电极反应式为 。
(2)若开始时开关K与b连接,则B极的电极反应式为 ,
总反应的离子方程式为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为 。此时通过阴离
子交换膜的离子数 (填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”) 导出。
③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
(4)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。
①N2H4在氧气中完全燃烧生成氮气,肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。肼-空气燃料电池放电时,负极的电极反应式是:
。
②传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式
30.(13分)(1)设反应①Fe(s)+CO2(g) ) FeO(s)+CO(g);△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g);△H=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)  FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
|
T/K |
K1 |
K2 |
|
973 |
1.47 |
2.38 |
|
1 173 |
2.15 |
1.67 |
从上表可推断,反应①是 (填“放”或“吸”)热反应。
现有反应③H2(g)+CO2(g) CO(g)+H2O(g);△H=Q3平衡常数为K3。
CO(g)+H2O(g);△H=Q3平衡常数为K3。
①根据反应①与②推导出K1、K2、K3的关系式K3= ;
可推断反应③是 (填“放”或“吸”)热反应。要使反应③在一定条件下建立的平衡右 移,可采取的措施有 。
移,可采取的措施有 。
A.缩小容器体积 B.降低温度 C.使用合适的催化剂
 D.设法减少CO的量 E.升高温度
D.设法减少CO的量 E.升高温度
②根据反应①与②推导出Q1、Q2、Q3的关系
式Q3= 。
(2)现在恒容密闭容器中通人一定量CO2,再慢慢通人H2,
使发生上述反应③,在其他条件不变时,若改变H2的起始量,
容器中CO的体积分数也随之改变,在图中画出CO的体积分
 数随n(H2)变化的示意图。
数随n(H2)变化的示意图。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com