
35.[生物-选修1生物技术实践](15分)
请在标有序号的空白处填空,并将序号及相应答案写在答题纸上:
下面是有关食醋和泡菜制作的实验。请回答:
(1)食醋可用大米为原料经三步发酵来制作:
第一步:大米经蒸熟、冷却后加入淀粉酶,将原料中的淀粉分解成①(填中间产物),然后进一步分解成葡萄糖,这一过程可用②(填淀粉指示剂)来检测,因为该试剂遇淀粉呈蓝色,遇上述中间产物呈红色。
第二步:用③菌将葡萄糖转化成乙醇,这一发酵过程中,玻璃发酵瓶不应完全密闭的主要原因是④。
第三步:用⑤菌将乙醇转化成乙酸,这一过程⑥氧气。
(2)泡菜发酵过程中,会产生多种酸,其中主要是⑦,还有少量的亚硝酸。对亚硝酸盐的定量测定可以用⑧法,因为亚硝酸盐与对氨基苯磺酸的反应产物能与N-1-萘基乙二胺偶联成⑨色化合物。进行样品测定时,还要取等量水进行同样的测定,目的是⑩。
34.[化学-物质结构与性质]
 铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第IB族。Cu2+的核外电子
排列式为__________________。
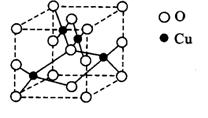
(2)右图是铜的某种氧化物的晶胞结构示意图,可
确定该晶胞中阴离子的个数为______。
(3)胆矾CuSO4·5H2O可成[Cu(H2O4)]SO4·H2O,其结构示意图如下:
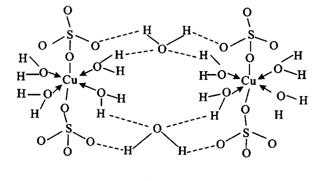
下列说法不正确的是________(填字母)
A.在上述结构示意图中,硫原子采用sp3杂化;
B.在上述结构示意图中,存在配位键、共价键和离子键;
C.胆矾是分子晶体,分子间存在氢键;
D.胆矾中的水在不同温度下会分步失去。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)]2+配离子,已知NF3与NH3的空间构型是三角锥形,但NF3不易与Cu2+形成配离子,其原因是______________________。
(5)Cu2O的熔点比Cu2S的________(填“高”或“低”),请解释原因____________。
33.[化学-有机化学基础]
A- 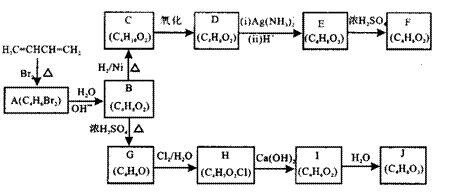 J均为有机化合物,它们之间的转化如下图所示:
J均为有机化合物,它们之间的转化如下图所示:
实验表明:
①D既能发生银镜反应,又能与金属钠反应放氢气;
②核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1;
③G能使溴的四氯化碳溶液褪色;
④1mol J与足量金属钠反应可放出22.4L氢气(标准状况)。
请根据以上信息回答下列问题:
(1)A的结构简式为_______________(不考虑立体异构),由A生成B的反应类型是__________反应;
(2)D的结构简式为___________;
(3)由E生成F的化学方程式为________________,E中的官能团有___________(填名称),与E具有相同官能团的E的同分异构体还有__________________(写出结构简式,不考虑立体异构);
(4)G的结构简式为_____________;
(5)由I生成J的化学方程式为____________________________________。
32.[物理-选修3-5模块](15分)
(1)大量氢原子处于同一较高的激发态,它们在向较低激发态或基态跃迁的过程中
A.可能发出一系列频率不同的光子 B.可能吸收一系列频率不同的光子
C.只吸收频率一定的光子 D.只发出某一频率的光
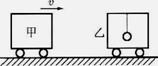 (2)如图所示,甲、乙两辆完全一样的小车,质量均为M,
(2)如图所示,甲、乙两辆完全一样的小车,质量均为M,
乙车内用绳吊一质重为M/2的小球,当乙车静止时,甲车以
速度v与乙车相碰,碰后连为一体,求刚碰后两车的速度及
当小球摆到最高点时的速度.
31.[物理-选修3-4模块](15分)
(1)两个弹簧振子甲的固有频率为f,乙的固有频率为10f,若它们均在频率为7f的驱动力作用下受迫振动,则( ).
A.振子甲的振幅较大.振动频率为f B.振子乙的振幅较大,振动频率为7f
 C.振子甲的振幅较大.振动频率为7f D.振子乙的振幅较大,振动频率为10f
C.振子甲的振幅较大.振动频率为7f D.振子乙的振幅较大,振动频率为10f
(2)如图,一透明半圆柱体折射率为 ,
,
半径为R、长为L。一平行光束从半圆柱体的矩
形表面垂直射入,从部分柱面有光线射出。求该
部分柱面的面积S。
30.(24分)智能温室无土栽培作物,易于管理,优质高产。该项技术广泛应用于现代农业。
(1)无土栽培所用营养液中的无机盐在植物体内的作用是_____________和________。植物因种类和生长发育阶段不同对无机盐的需求也不同,所以应视具体情况调整____________。供作物__________性吸收无机盐离子。
(2)营养液中某些无机盐离子浓度比根细胞内的低,植物仍可通过____________方式吸收。若栽培池内较长时间通气不畅,作物根部可能出现的症状是___________,其生理原因是____________。
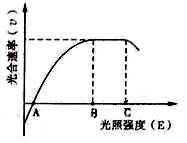 (3)下图表示温室内光照强度(E)与作物光合速率(v)的关系。在温度、水分和无机盐均适宜的条件下,当E<B时,增大光合速率的主要措施
(3)下图表示温室内光照强度(E)与作物光合速率(v)的关系。在温度、水分和无机盐均适宜的条件下,当E<B时,增大光合速率的主要措施
是____________;当B<E<C时,限制作物增产的主要因
素是____________;当E>C时,可采取____________措
施,保证作物的最大光合速率,如遇连阴天,温室需补
光,选用____________光最有效。
(4)用适宜浓度的2,4,-D处理番茄花蕾可提高坐果率。请设计实验方案,确定施用2,4-D的最适浓度。______________________________________________。
选考题(每科选做1题)
考生从给出的2道物理题、2道化学题中任选1题解答,2道生物题中任选1题解答并用2B铅笔在答题卡上把所选题目的对应题号涂黑。注意所做题目必须与所涂题目一致,在答题卡选答区域指定位置答题。
29.(12分)回答下列与细胞有关的实验问题。
(1)下列4项实验中,需保持细胞生理活性的有____________(填序号)。
①观察叶绿体和原生质的流动 ②观察洋葱鳞片叶内表皮细胞中DNA的分布
③探究酵母菌的呼吸方式 ④红细胞中血红蛋白的提取和分离
(2)按下面步骤进行质壁分离实验。
步骤一:在洁净的载玻片中央加一滴清水,取一片藓类小叶,盖上盖玻片。
步骤二:从盖玻片一侧滴入0.3g/mL的蔗糖溶液,在盖玻片的另一侧用吸水纸吸引。这样重复几次,使盖玻片下面的藓类小叶浸润在0.3g/mL的蔗糖溶液中。
步骤三:在显微镜下观察,结果如图所示。
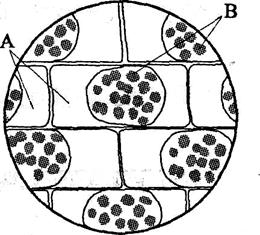 ①图中A、B处的颜色分别是__________ 。
①图中A、B处的颜色分别是__________ 。
②如果上述实验步骤二中从盖玻片的一
侧滴入的是加有伊红(植物细胞不吸收的
红色染料)的0.3g/mL的蔗糖溶液,
则在显微镜下观察到A、B处颜色分别是
______________ 。
③如果将上述实验步骤二中浸润在0.3g/mL
的蔗糖溶液中的藓类小叶的装片,放在80℃条件
下处理一段时间(装片中的藓类小叶保持在0.3g/mL的蔗糖溶液中)。在显微镜下清晰地观察到细胞结构后,为更准确地判断A处颜色,对显微镜的操作方法是______________ 、______________。如果A处呈绿色,可能的原因是____________ 。
28.(18分)鸭蛋蛋壳的颜色主要有青色和白色两种。金定鸭产青色蛋,康贝尔鸭产白色蛋。为研究蛋壳颜色的遗传规律,研究者利用这两个鸭群做了五组实验,结果如下表所示。
|
杂交组合 |
第1组 |
第2组 |
第3组 |
第4组 |
第5组 |
|
|
康贝尔鸭♀×金定鸭♂ |
金定鸭♀×康贝尔鸭♂ |
第1组的F1自交 |
第2组的F1自交 |
第2组的F1♀×康贝尔鸭♂ |
||
|
后代所产蛋(颜色及数目) |
青色(枚) |
26178 |
7628 |
2940 |
2730 |
1754 |
|
白色(枚) |
109 |
58 |
1050 |
918 |
1648 |
请回答问题:
(1)根据第1、2、3、4组的实验结果可判断鸭蛋壳的 ____________色是显性性状。
(2)第3、4组的后代均表现出____________现象,比例都接近____________ 。
(3)第5组实验结果显示后代产青色蛋的概率接近____________ ,该杂交称为____________,用于检验 ____________ 。
(4)第1、2组的少数后代产白色蛋,说明双亲中的____________鸭群混有杂合子。
(5)运用____________方法对上述遗传现象进行分析,可判断鸭蛋壳颜色的遗传符合孟德尔的____________定律。
27.(14分)下表列出了部分常见的含有10电子和18电子的粒子,试回答下列问题:
|
10电子粒子 |
CH4、NH3、H2O、HF、Na+、Al3+、NH4+、F- |
|
18电子粒子 |
H2S、HCl、K+、S2-、HS-、Cl- |
(1)其中空间构型为四面体的分子是_____________;受热最难分解的分子是_________。
(2)其中能与OH-反应的分子有________________;既能与H+反应又能与OH-反应的粒子有_______________。
(3)其中在水溶液中能够促进水电离的粒子有__________________________;由表中粒子形成的某些离子化合物的水溶液呈酸性,试写出其中一个离子方程式______________。
(4)由第二周期元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可作火箭发动机的燃料,B是一种常见强氧化剂。已知16g 液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838kJ热量。写出A与B反应的热化学方程式:________________________________________。
26.(14分)有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可两两组成甲、乙、丙、丁四种化合物,各化合物中原子个数之比如下表:
|
|
甲 |
乙 |
丙 |
丁 |
|
化合物中各元素原子个数之比 |
A:C=1:1 |
B:A=1:2 |
D:E=1:3 |
B:E=1:4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;在元素周期表中,C是E的邻族元素,化学性质活泼;D和E位于同一周期,且D和E的原子序数之和为30。
(1)D和E同属第____________周期元素,推断依据是____________________________。
(2)根据题目提供的条件,推断E在周期表中的族序数:__________________________。
(3)向甲的水溶液中加入MnO2,反应的化学方程式为_____________________________。
(4)已知乙的相对分子质量小于甲。在实验室常用什么方法制得乙?________________。(用化学方程式表示)
(5)向30mL 1mol·L-1 的KI溶液中依次注入下列试剂:①1mL 5mol·L-1盐酸 ②0.5mL
30%的甲溶液 ③1mL丁。经充分振荡后,可得紫色溶液。这种紫色溶液是_________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com