
1.第28届国际地质大会提供资料显示,海底有大量的天然气水合物,可满足人类1000年的能源需求。天然气水合物是一种晶体,晶体中平均每46个水分子构建8个笼,每个笼中可容纳1个CH4分子或1个游离的H2O分子,据以上信息,完成第⑴、⑵题:
⑴ 下列关于天然气水合物中两种分子极性的叙述正确的是
A.两种都是极性分子 B.两种都是非极性分子
C.CH4是极性分子,H2O是非极性分子 D.H2O是极性分子,CH4是非极性分子
⑵ 若晶体中每8个笼只有6个笼容纳了CH4分子,另外2个笼被游离的H2O分子填充,则天然气水合物的平均组成可表示为:
A.CH4·14H2O B.CH4·8H2O C.CH4·(23/3)H2O D.CH4·6H2O
8. 现有原子序数之和为51的五种短周元素A、B、C、D、E。已知A的单质在常温下为无色气体;B原子的最外层电子数比次外层电子数多3个;C和B属于同一主族;D的最高正价的代数和为4,其最高价氧化物对应的水化物的酸性在同主族元素中最强,E元素最外层电子数与其K层电子数相同。
①试写出它们的元素符号。
②写出B的氢化物的电子式。
③B的气态氢化物与D的气态氢化物互相作用生成的物质,其电子式为_________或___________.
[课后作业]
7.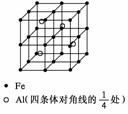 晶体是质点(分子、离子或原子等)在空间有规则地排列、具有整齐外形、以多面体出现的固体物质。在空间里无限地周期性的重复能形成晶体的、具有代表性的最小单元,称为晶胞。一种Al-Fe合金的立体晶胞如下图所示。请据此回答下列问题:
晶体是质点(分子、离子或原子等)在空间有规则地排列、具有整齐外形、以多面体出现的固体物质。在空间里无限地周期性的重复能形成晶体的、具有代表性的最小单元,称为晶胞。一种Al-Fe合金的立体晶胞如下图所示。请据此回答下列问题:
⑴ 确定该合金的化学式__________。⑵ 若晶体的密度=ρ g/cm3, 则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为____________cm。⑶ 取2.78 g的该合金粉末溶于100 mL某稀硝酸溶液中,待反应完全后得到1.12 L NO气体(标准状况,设两者恰好完全反应),则原硝酸溶液的物质的量浓度为______mol/L,反应后溶液中Fe3+离子的物质的量浓度为______mol/L。
6.下列有关晶体的叙述中,错误的是
A.金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子
B.在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(或Na+)
C.白磷晶体中,微粒之间通过共价键结合,键角为60°
D.离子晶体在熔化时,离于键被破坏,而分子晶体熔化时,化学键不被破坏
5.下列叙述正确的是
A.原子晶体中,共价键的键能越大,熔沸点越高
B.分子晶体中,分子间作用力越大,该分子越稳定
C.分子晶体中,共价键的键能越大,熔沸点越高
D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体
4.下列每组物质发生状态变化所克服的粒子间的相互作用力属于同种类型的是
A.食盐和蔗糖的熔化 B.钠和硫的熔化
C.碘和干冰的升华 D.二氧化硅和氧化钠的熔化
3.A、B、C、D、E是中学化学中常见的分子或离子,它们具有相同的电子数,且A是由5个原子核组成的粒子。它们之间可以发生如下反应:A+B=C+D,B+E=2D;且D与大多数酸性氧化物、碱性氧化物均能反应。
(1)写出A的电子式_________;写出E的电子式_________。
(2)写出化学式:B_________,C_________,D_________,E_________
2.用电子式表示下列化合物。
(1)CS2 __________________。
(2)MgCl2 __________________。
1.KCl、NH4F、NH3、NaOH等物质中,只存在共价键的是__________只存在离子键的是_________,即有离子键又有共价键的是_________。
[例1]下列叙述正确的是
A.微粒间以分子间作用力结合的晶体,其熔点不会很高
B.正四面体构型的分子中,键角一定为109°28'
C.离子晶体中含有离子键,也可能含有共价键
D.金属阳离子只能与阴离子构成晶体
[例2]有下列物质:①白磷,②金刚石,③石墨,④二氧化硅,⑤甲烷,⑥四氯化碳,⑦单质硅,⑧铵根离子;其分子结构或晶体单元结构中存在正四面体的是
A.除③外 B.只有①②⑤⑥ C.除③⑧外 D.除 ③④⑦⑧
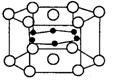 [例3]2001年报道硼和镁形成的化合物刷新了金属化合物超导温度的最高纪录。如图所示为该化合物的晶体的结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱内。则该化合物的化学式为
[例3]2001年报道硼和镁形成的化合物刷新了金属化合物超导温度的最高纪录。如图所示为该化合物的晶体的结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱内。则该化合物的化学式为
A.MgB B.MgB2 C.Mg2B D.Mg3B2
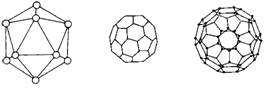 [例4]石墨和金刚石是已知结构的单质碳的存在形式,1985年人们又发现了一种新的单质碳的形式:碳笼。这种碳单质具有笼状结构(如图),其中最丰富的是C60,其结构形如足球,如最右图所示,故称为足球分子。可以认为它是由正二十面体切掉十二个顶点形成的,试回答:
[例4]石墨和金刚石是已知结构的单质碳的存在形式,1985年人们又发现了一种新的单质碳的形式:碳笼。这种碳单质具有笼状结构(如图),其中最丰富的是C60,其结构形如足球,如最右图所示,故称为足球分子。可以认为它是由正二十面体切掉十二个顶点形成的,试回答:
⑴ C60有 个六元环, 个五元环;
⑵ 这些碳原子间以何种形式成键?
⑶ 在下列溶剂中,C60溶解度最小的是 , 最大的是 。
A.水 B.甲醇 C.苯 D.酒精
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com