
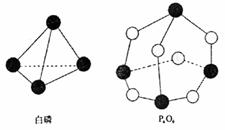
12.化学反应可视为旧键断裂和新键形成的过程,
化学键的键能是形成(或拆开)1mol化学键时释
放(或吸收)出的能量。已知白磷和P4O6的分子
结构如右图所示,现提供以下化学键的键能(kJ·mol-1)
P-P:198、P-O:360、O-O:498。
则反应P4(白磷)+3O2===P4O6的反应热△H为 __________________。
10.下列性质:①晶体可溶于水;②具有较高的熔点;③水溶液能导电;④熔融状态能导电,其中可能证明某化合物一定存在离子键的是_____(填编号)。
 11.在NaCl晶体中,如果Na+与Cl-距离为a cm,设晶体密度为ρg/cm3,则阿伏加德罗常数为NA可表示为____________。
11.在NaCl晶体中,如果Na+与Cl-距离为a cm,设晶体密度为ρg/cm3,则阿伏加德罗常数为NA可表示为____________。
9.由钾和氧组成的某种离子晶体中,阳离子和阴离子的质量之比为13∶8,其中阴离子只有过氧离子(O22-)和超氧根离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为
A.1∶1 B.2∶1 C.1∶2 D.1∶3
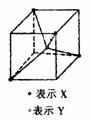
8.常见的离子晶体类型有5种,右图是其中一种空间构型,
则该晶体中X、Y的离子个数之比可能为
A.4∶ l B.2∶1 C.1∶1 D.1∶2
7.下列事实与氢键有关的是
A.水加热到很高的温度都难以分解 B.水结成冰体积膨胀,密度变小
 C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
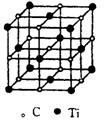
6.最近科学家们发现一种由钛原子和碳原子构成的气态团簇分子,如图所示。顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是
A.TiC B.Ti6C7 C.Ti14C13 D.Ti13C14
5.美国加州 Livermore国家实验室物理学家Choong-Shik和他的同事们,在40Gpa的高压容器中, 用Nd-YbLiF4激光器将液态二氧化碳加热到1800K,二氧化碳转化为与石英具有相似结构的晶体。估计该晶体可能具有的结构或性质是
 A.该晶体仍属于分子晶体 B.硬度与金刚石相近
A.该晶体仍属于分子晶体 B.硬度与金刚石相近
C.熔点较低 D.硬度较小
4.由下列各组的三种元素构成的化合物中既有离子晶体,又有分子晶体的是
A.H、O、C B. Na、S、O C.H、N、O D.H、S、O
3.在下列各说法中都包含有前后两个数值,其中前者小于后者的是
A.质量分数为10℅的硫酸溶液与质量分数为20℅的硫酸溶液的密度
B.卤素氢化物中,H-F键与H-Cl键的键长
C.正戊烷与新戊烷的沸点 D.钠原子与氯原子的半径
2.CaC2和 MgC2都是离子化合物,下列叙述中正确的是
A.MgC2和CaC2都能跟水反应生成乙炔 B.C22-的电子式为[C::C]2-
C.CaC2在水中以Ca2+和C22-形式存在 D.MgC2的熔点低,可能在 100℃以下
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com