
1.pH的定义:pH=-lg[H+]
注意: (1) 25℃时:PH +POH==14 ,100℃时: PH +POH==12
(2)常见的PH:
(3)PH的适用范围:CH+ (10-14 ,1),即PH常温下的范围为(0 ,14)
注意:任意水溶液中[H+]≠0,但pH可为0,此时[H+]=1mol/L,一般[H+]>1mol/L时,pH<0,故直接用[H+]表示.
7.影响水的电离平衡因素
(1)温度,升温度促进水的电离,降温则相反
(2)向纯水中外加酸碱,会抑制水的电离。
①只要酸的pH值相等(不论强弱、不论几元)对水的抑制程度相等,碱也同理。
②若酸溶液的pH值与碱溶液的pOH值相等,则两种溶液中水的电离度相等。
如pH=3的盐酸溶液与pH=11的氨水溶液在室温下,由水电离出的
[H+]水=[OH-]水=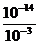 =10-11mol/L
=10-11mol/L
(3)向纯水中外加弱离子的盐将促进水的电离 ,且当强酸弱的碱盐的pH和强碱弱酸盐的pOH值相等时(同一温度),则促进程度相等。
6.可以根据纯水电离的[H+]的大小与25℃时[H+]的大小相比较,从而判断溶液所处的温度;若溶液所处的温度均为常温,还可以判断溶液的性质。;
5.Kw的重要作用:担负着将[H+] 、[OH-]转化的重任;担负着有关水的电离的计算的重任。。
4.涉及水的电离就要联想Kw,要描述Kw的表达式必须注意[H+]或[OH-]哪种完全浓度完全来自于水:
(1)在酸溶液中:
(2)在碱性溶液中:
(3)在碱溶液中:
(4)在酸性溶液中:
如pH=4的NH4Cl溶液与pH=10的NaAc溶液中,(室温)由水电离出的
[H+]水=[OH-]水= =10-4mol/L
=10-4mol/L
3.无论何种性质的溶液,由水电离的[H+] = [OH-]始终恒成立。
2.影响Kw的因素
Kw与溶液中[H+]、[OH-]无关,只与温度有关。
水的电离为吸热过程,所以当温度升高时,水的电离程度增大,Kw也增大。故谈Kw必须指明温度。
1. 实验证明,纯水微弱的导电性,是极弱的电解质:
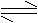 H2O H++OH,当温度一定时[H+]·[OH-] =Kw是一个常数称为水的离子积常数,简称水的离子积。其中:
H2O H++OH,当温度一定时[H+]·[OH-] =Kw是一个常数称为水的离子积常数,简称水的离子积。其中:
25℃:[H+] = [OH-] = 10-7 , Kw= [H+]·[OH-]= =10-14 100℃:[H+] = [OH-] = 10-6, , Kw= [H+]·[OH-]=10-12
对一元弱酸满足:CH+=C酸 ∝ 或C酸=
注意:酸与碱混合时发生中和反应,但不一定恰好完呈中和。即使恰好完全中和,也不一定溶液呈中性,由生成的盐能否水解及水解情况而定,另外酸碱的强弱不同,提供反应物的量不同也影响着反应后溶液的性质。一般酸或碱过量化生成的盐水解对溶液的酸碱性影响大。
下面把常见的几种情况分列出来.
①等物质的量浓度的一元弱酸一元强碱溶液等体积混合溶液pH>7(由生成的强碱弱酸盐水解决定)
②等物质的量浓度的一元强酸与一元弱碱溶液等体积混合后溶液pH<7(由生成的强酸弱碱盐水解决定)
③等物质的量浓度的一元强酸与强碱溶液等体积混合后溶液pH=7(因生成强酸强碱盐不水解)
想一想:若酸或碱之一是多元,情况又怎样?
④当pH=pOH的强酸与强碱溶液以等体积混合后pH=7(与酸、碱的几元性无尖)
⑤当pH=3的某一元酸溶液与pH=11的一元强碱以等体积混合后pH≤7。(考虑酸有强弱之分,若分弱酸,制反应后酸过量)
⑥当pH=3的某一元强酸pH=11的一元碱溶液的以等体积混合后pH≥7(同理⑤,弱碱过量)
⑦将pH=3的酸溶液和pH=11的碱溶液以等体积混合后溶液pH=无法确定.
再想一想:⑤⑥⑦与酸、碱的几元性有无关系?
第二节水的电离平衡和溶液的PH
3.两个重要结论:
(1)PH相同的强弱酸等倍数稀释前者PH较高,或强酸的PH变化较大。
(2)C酸相同的同元强弱酸等倍数稀释则反之。
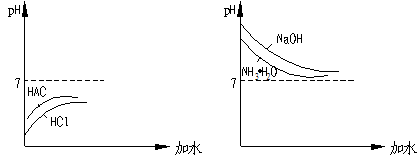
例如 ①等物质的量浓度的盐酸和醋酸,氢氧化钠和氨水分别加水稀释。溶液的pH值变化,图示如下:
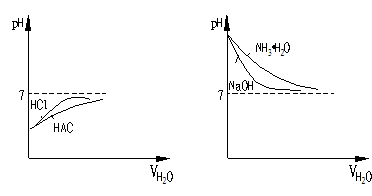
②若把上述问题,换成等pH值,图示又怎样呢?
注意:
①酸无论怎样稀释,不可能成为碱性;若无限稀释,则pH只能无限接近7且小于7.
②碱无论怎样稀释,不可能成为酸性;若无限稀释,则pH只能无限接近7且大于7
③当起始强酸、弱酸的pH相同,稀释后为达仍相同,则稀释倍数一定是弱酸大小强酸(强碱、弱碱类同)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com