
3、质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系:C(H3O+)+C(H2CO3)=C(NH3)+C(OH-)+C(CO32-)。
[巩固]
2、物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如NaHCO3溶液中nC(Na+):nC(C)=1:1,推出:C(Na+)=C(HCO3-)+C(CO32-)+C(H2CO3)
1、 电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。如NaHCO3溶液中:nC(Na+)+nC(H+)=nC(HCO3-)+2nC(CO32-)+nC(OH-)推出:C(Na+)+C(H+)=C(HCO3-)+2C(CO32-)+C(OH-)
3、物质的量浓度相同的下列溶液:①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3
⑤NH4HCO3,按C(CO32-)由小到大排列顺序正确的是 ( )
A.⑤④③②① B.③⑤②④① C.③②⑤④① D.③⑤④②①
题型二
[例3]把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( ) A.C(CH3COO-)>C(Na+) B.C(CH3COOH)>C(CH3COO-) C.2C(H+)=C(CH3COO-)-C(CH3COOH) D.C(CH3COOH)+ C(CH3COO-)=0.01mol/L
[点拨]此题实质上是0.05mol/L的CH3COOH溶液和0.05mol/L的CH3COONa溶液的混合溶液。由电荷守恒关系可得: c(H+)+c(Na+)=c(CH3COO-)+c(OH-) (1)
由物料守恒关系可得: c(CH3COOH)+c(CH3COO-)=c(Na+)×2=0.01mol/L (2) 由(2)可知D正确。 将(1)×2+(2)可得: 2c(H+)=c(CH3COO-)+2c(OH-)-c(CH3COOH)(3)C选项错误。
[例4]用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中C(CH3COO-)>C(Na+),对该混合溶液的下列判断正确的是( )
A.C(H+)>C(OH-) B.C(CH3COOH)+C(CH3COO-)=0.2 mol/L
C.C(CH3COOH)>C(CH3COO-) D.C(CH3COO-)+C(OH-)=0.2 mol/L
[点拨] CH3COOH和CH3COONa的混合溶液中,CH3COOH的电离和CH3COONa的水解因素同时存在。已知C(CH3COO-)>C(Na+),根据电荷守恒C(CH3COO-)+C(OH-)=C(Na+)+C(H+),可得出C(OH-)<C(H+)。说明混合溶液呈酸性,进一步推测出0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液中,电离和水解这一对矛盾中起主要作用是电离,即CH3COOH的电离趋势大于CH3COO-的水解趋势。根据物料守恒,可推出(B)是正确的。
[规律总结]
2、将0.4mol/L盐酸和0.2mol/L的NaAlO2溶液等体积混合,所得溶液中离子浓度由小到大的顺序是 。
1、Na2S溶液中各离子浓度由小到大的顺序是 。;
3、分清他们的主要地位和次要地位
[巩固]
2、掌握解此类题的三个思维基点:电离、水解和守恒
1、必须有正确的思路:
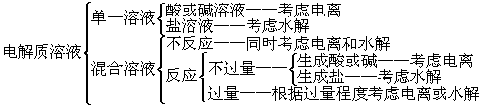
1.理解电解质的电离平衡概念以及电离度的概念。 2.理解水的电离、盐类水解的原理。了解盐溶液的酸碱性。
[经典题型]
题型一
[例1]在氯化铵溶液中,下列关系式正确的是
A.C(Cl-)>C(NH4+)>C(H+)>C(OH-) B.C(NH4+)>C(Cl-)>C(H+)>CC(OH-)
C.C(Cl-)=C(NH4+)>C(H+)=C(OH-) D.C(NH4+)=C(Cl-)>C(H+)>C(OH-)
[点拨]NH4Cl是可溶性的盐,属于强电解质,在溶液中完全电离NH4Cl=NH4++Cl-。因为NH4Cl是强酸弱碱所生成的盐,在水中要发生水解;NH4++H2O 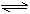 NH3·H2O+H+,所以C(NH4+)比C(H+)及C(OH-)大得多;溶液因水解而呈酸性,所以C(H+)>C(OH-)。又由于水解反应是中和反应的逆反应,相对于中和来说是次要的,综合起来,不难得出:C(Cl-)>C(NH4+)>C(H+)>C(OH-)。答案为A。
NH3·H2O+H+,所以C(NH4+)比C(H+)及C(OH-)大得多;溶液因水解而呈酸性,所以C(H+)>C(OH-)。又由于水解反应是中和反应的逆反应,相对于中和来说是次要的,综合起来,不难得出:C(Cl-)>C(NH4+)>C(H+)>C(OH-)。答案为A。
[例2]在0.1 mol/l的NH3·H2O溶液中,下列关系正确的是
A.C(NH3·H2O)>C(OH-)>C(NH4+)>C(H+) B.C(NH4+)>C(NH3·H2O)>C(OH-)>C(H+)
C.C(NH3·H2O)>C(NH4+)=C(OH-)>C(H+) D.C(NH3·H2O)>C(NH4+)>C(H+)>C(OH-)
[点拨] NH3·H2O是一元弱酸,属于弱电解质,在水溶液中少部分发生电离(NH3·H2O  NH4++OH-),所以C(NH3·H2O)必大于C(NH4+)及C(OH-)。因为C(OH-)=C(H+)+C(NH4+),所以C(OH-)>C(NH4+)。综合起来,C(NH3·H2O)>C(OH-)>C(NH4+)>C(H+)。答案为A。
NH4++OH-),所以C(NH3·H2O)必大于C(NH4+)及C(OH-)。因为C(OH-)=C(H+)+C(NH4+),所以C(OH-)>C(NH4+)。综合起来,C(NH3·H2O)>C(OH-)>C(NH4+)>C(H+)。答案为A。
[规律总结]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com