
3.运用元素单质及其化合物的性质进行物质的推断及检验。
[经典题型]
题型Ⅰ:(07年高考全国卷)提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
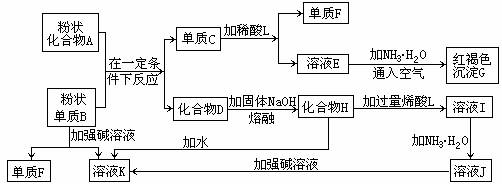 (1)单质F是_____________________。
(2)写出由E生成G的离子反应方程式(或化学方程式)________________________。
(3)溶液I中所含金属离于是_____________________。
(4)由CEF若改用浓酸,则不能选用的浓酸是(写分子式)____________________。
(1)单质F是_____________________。
(2)写出由E生成G的离子反应方程式(或化学方程式)________________________。
(3)溶液I中所含金属离于是_____________________。
(4)由CEF若改用浓酸,则不能选用的浓酸是(写分子式)____________________。
[点拨]本题看似复杂,但有一明显突破口,即溶液E中加氨水、通入空气得红褐色沉淀,此沉淀是Fe(OH)3,由此推断C为单质Fe,F为H2,E为亚铁盐;再往前推,粉状化合物和粉状单质发生置换反应,生成单质铁,应为铝热反应,故B为Al,D为Al2O3,H为NaAlO2,溶液I中含有Na+、Al3+。
答案:(1)H2 (2)4Fe2+ + 8NH3·H2O + O2 + 2H2O = 4Fe(OH)3↓+ 8NH4+
或:Fe2+ + 2NH3·H2O = Fe(OH)2↓+ 2NH4+ 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 (3)Al3+ 和Na+
(4)H2SO4(或HNO3)
[规律总结]铁作为一种变价金属,是高考命题的热点,在离子共存、离子方程式、金属的腐蚀中铁起着重要的角色,特别是以铁为载体,在化学实验、物质推断和化学计算都有可能出现。
题型Ⅱ:(2006年高考全国卷)下图每一方框中的字母代表一种反应物或生成物:
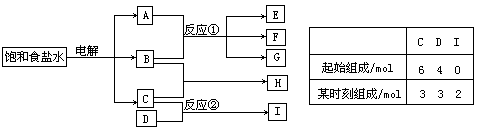
物质A跟B反应生成物质E、F和G;物质C跟D反应生成物质I,某温度下该反应起始和某时刻的反应混合物组成如右上表格所示。请填写下列空白:
(1)物质H的化学式是_____________。
(2)反应①的化学方程式是_______________________________________________。
(3)反应②的化学方程式(须注明反应条件)是_______________________________。
[点拨]本题为一综合推断题,突破口为饱和食盐水电解:
2NaCl +2H2O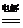 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
可得A、B、C分别为NaOH、H2、Cl2,根据题意推断C为H2,进而得B为Cl2,A为NaOH,所以H为HCl;由题中表格可知C和D反应的物质的量之比:3C + D = 2I,所以I中应有3个H原子,D为双原子分子N2。
答案:(1)HCl
(2)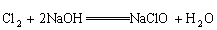
(3)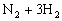

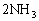
题型Ⅲ:有某白色粉末,取出少量溶于水,用铂丝蘸取溶液做焰色反应实验,焰色呈黄色,再透过钴玻璃观察,焰色呈浅紫色。另取少量粉末加热无明显现象,冷却后加入稀盐酸则逸出无色、无气味的气体,该气体不能使品红溶液褪色,但能与氢氧化钡溶液产生白色沉淀。继续向原反应液中加盐酸至过量,再滴入BaCl2溶液,有白色沉淀生成。则原来的混合物白色粉末中肯定含有的离子是______________。写出有关的离子方程式:_________________________________________________。
[点拨]由颜色反应,肯定白色粉末中含有Na+和K+。由粉末与盐酸反应逸出气体的性质,判断气体是CO2,但可能由CO32-或HCO3-与酸反应而得。粉末加热不产生气体,排除了NaHCO3或KHCO3中的HCO3-。从后一步实验得到难溶于酸的白色钡盐,确定出原粉末中有SO42-.
答案:K+、Na+、CO32-、SO42-;
CO32- + 2H+ =CO2↑+H2O,CO2 + Ba2+ +2OH- = BaCO3↓+ H2O,
SO42- + Ba2+ = BaSO4↓
[随堂作业](45分钟)
2.掌握金属元素单质及其化合物的相互转化关系。
1.掌握非金属元素单质及其化合物的相互转化关系。
14.(1)
 (2)①当a×M×1.5=bN时,沉淀总量最多
②当bN³2aM时,沉淀总质量最大
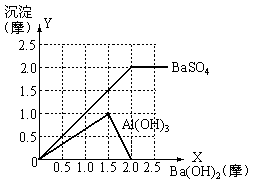
(3)①n³2m时,BaSO4=2m(摩),Al(OH)3=0(摩)
②1.5m£n£2m时,BaSO4=n(摩),Al(OH)3=m-(2n-3m)=4m-2n(摩)
③n£1.5m时,BaSO4=n(摩),Al(OH)3=
(2)①当a×M×1.5=bN时,沉淀总量最多
②当bN³2aM时,沉淀总质量最大
(3)①n³2m时,BaSO4=2m(摩),Al(OH)3=0(摩)
②1.5m£n£2m时,BaSO4=n(摩),Al(OH)3=m-(2n-3m)=4m-2n(摩)
③n£1.5m时,BaSO4=n(摩),Al(OH)3=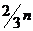 (摩)
(摩)
13.(1)
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
|
残留固体成份 |
Fe Cu |
Cu |
Cu |
- |
- |
- |
|
溶液中的金属离子 |
Fe2+ |
Fe2+ |
Fe2+ Cu2+ |
Fe2+ Cu2+ |
Fe2+ Fe3+ Cu2+ |
Fe3+ Cu2+ |
(2) 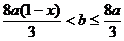 (3) a=0.04 b=0.12
(3) a=0.04 b=0.12
12.
|
实验方法 |
实验过程中所发生
反应的化学方程式 |
实验所用仪器 (用编号表示) |
实验需直接测定的 有关物理量 (用文字说明) |
|
1 |
H2SO4+Zn→ZnSO4+H2↑ H2+CuO 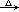 Cu+H2O Cu+H2O |
①②③⑦ |
实验前样品和硬质玻璃管的总质量(或硬质玻璃 管的质量) 实验后Cu及硬质玻璃管的总质量 |
|
2 |
H2SO4+CuO→CuSO4+H2O |
①⑤⑧⑨ |
过滤后剩余固体的质量 |
|
3 |
2Cu+O2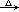 2CuO 2CuO |
①④⑥⑦⑧ |
实验前坩埚与样品总质量 (或坩埚质量) 实验后坩埚与CuO总质量 |
10.56mL 11. 2.1g
1.BC 2.D 3.D 4.A 5.B 6.BC 7.C 8.A 9.C
14. 向明矾[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至过量。
(1)当明矾为1摩尔时,试在图中画出生成的每种沉淀物质的量随Ba(OH)2物质的量变化的曲线(表明化学式)
 (2)当向体积为a升,浓度为Mmol/L的明矾溶液中滴加b升、Nmol/L的Ba(OH)2溶液时,用含a、M、N的代数式表示:
①当b满足
时,沉淀的总物质量最大
②当b满足
时,沉淀的总质量最大
(3)若向含m摩KAl(SO4)2的溶液中加入含n摩尔Ba(OH)2溶液,试讨论
(2)当向体积为a升,浓度为Mmol/L的明矾溶液中滴加b升、Nmol/L的Ba(OH)2溶液时,用含a、M、N的代数式表示:
①当b满足
时,沉淀的总物质量最大
②当b满足
时,沉淀的总质量最大
(3)若向含m摩KAl(SO4)2的溶液中加入含n摩尔Ba(OH)2溶液,试讨论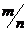 取不同范围值时,沉淀中各组分的物质的量是多少?
取不同范围值时,沉淀中各组分的物质的量是多少?
[答案]
13. 现有铁和铜组成的合金共a摩尔,其中铜的物质的量分数为x,研成粉未状后全部投入含b摩尔HNO3的稀溶液中,微热使其充分反应,且HNO3的还原产物只有NO。试回答下列问题: (1)用微粒符号填写下列空白(列举出全部可能出现的情况)
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
|
残留固体成份 |
|
|
|
|
|
|
|
溶液中的金属离子 |
|
|
|
|
|
|
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、x表示) 。 (3)当x=0.5,溶液中Fe3+和Fe2+的物质的量相等,在标准状况下共产生672毫升NO气体,求a和b的值(写出计算过程)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com