
5.山东在中国近现代海军建设发展历程中具有特殊的地位。2009年4月,胡锦涛主席在山东青岛对中外海军舰艇进行了盛大的阅军仪式,庆祝中国人民解放军海军成立60周年。而在山东另一座海滨城市威海,每次中央电视台在插播山东各城市旅游广告时,提到威海的刘公岛说“刘公岛不仅仅是一个岛”,其实刘公岛还承载着一段历史,它承载的是那一段历史呢?( )
A、六十年前,刘公岛见证了中国人民解放军海军在此正式成立的光荣历史
B、甲午战争中黄海海战就是在刘公岛打响
C、刘公岛见证了北洋海军由成立到全军覆灭的一段惨痛历史
D、中国人名解放军曾在此歼灭国民党集团的所有海军舰艇
4.《晚清大变局中的人物和思潮》中评价某人所写的一本书,写到:它的历史作用在于它抛弃了那些不切实际的空想,勇敢地承认了能人的创造性劳动和富者经营的事业的价值和正当性。通过实行专利制度,“准富者请人雇工”,奖励私人兴办各种工业、交通企业、开矿、办银行、办“学馆”和各种福利事业,从而把旧式的农民战争与切合当时中国需要的历史进步事业直接联接起来。这一“某人”是( )
A、洪秀全 B、洪仁玕 C、孙中山 D、李鸿章
3.某同学在图书馆查阅资料时,发现了中国古代某地居民的一份职业结构表,据此推断这种职业结构最可能出现在何时何地 ( )
|
|
自耕农、地主 |
佃农 |
工人 |
商人 |
|
占总人口比例 |
24% |
36% |
30% |
lO% |
A、汉代江南地区 B、唐代关中地区
C、宋代关中地区 D、明代江南地区
2.《吕氏春秋》:“今以众地者,公作则迟,有所匿其力也;分地则速,无所匿其力也。”与这一历史现象关联最为紧密的图片是 ( )
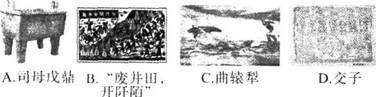
1.河南大学教授玉立群指出“古来帝王,有秦始皇至清代宣统,正统偏安者共二百余人,真正懂得国家政体并善以此治国、王而不藩者 , 不过秦皇、汉武、宋太祖、清圣祖 ( 康熙 ) 四人而已。”其中的“国家政体”指( )
A、王位世袭制 B、中央集权制 C、文官体制 D、监察体制
21.(12分).
(1)I.图表法、图象法是常用的科学研究方法。
短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第
 族。
族。
II.图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是: (填“a”或“b”),理由是: 。
(2).人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。
试回答下列问题:
I.Ti元素的基态原子的价电子层排布式为 ;
 II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,
II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,
其中以+4价的Ti最为稳定;
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、
话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结
构示意图如右图,它的化学式是 ;
晶体内与每个“Ti”紧邻的氧原子数为 个。
②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,
另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配503589608合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为 。
20.(10分)碘酸钾是一种白色结晶粉末,无503589608臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:
I2+KClO3+H2O--KH(IO3)2+KCl+503589608Cl2 ↑(未配平)

(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同,请配平该反应的化学方程式:
______________________________________________________________;
(2)步骤②中,用稀酸酸化的作用是____________________________________________;在稀硝酸和稀盐酸中不能选用的酸是:_________,其原因是
503589608 ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为
;
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 。
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
19.(8分)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
⑴已知KBrO3在反应中得到电子,则该反应的还原剂是 503589608 。
⑵已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为 。
⑶根据上述反应可推知 。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4 > KBrO3
C.还原性:AsH3>X D.还原性:X > AsH3
⑷将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
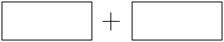
17.(10分)下图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去)。

已知:E为红棕色固体,K为浅绿色溶液;反应①、②都是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G分子构型为三角锥形,化合物M由两种元素组成,分子内共有58个电子。
(1)F的化学式 ;G的水溶液中,最多的阳离子是 。
(2)写出K与H反应的离子方程式: ;
G与H反应的化学方程式: 。
(3)在实验室中,向饱和H水溶液中加入CaCO3粉末,充分反应后过滤,可制得浓度较大的P的水溶液。用化学平衡移动的原理加以解释
。
 18.(1)(3分)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。请把与下面元素有关性质相符的曲线标号(a、b、c、d)填入相应的空格中:
18.(1)(3分)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。请把与下面元素有关性质相符的曲线标号(a、b、c、d)填入相应的空格中:
①ⅡA族元素的最外层电子数 。 ②第3周期元素的最高化合价 。
③F-、 Na+ 、Mg2+、Al3+的离子半径 。
(2)(7分)元素X、Y、Z、M、N均为短周期主族元素,且原子序数503589608依次增大。已知Y原子
最外层电子数与核外电子总数之比为3∶4;M原子的最外层电503589608子数与次外电子数之比为
3∶4;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,据此回答:
①Y和M形成的常见化合物的化学式是 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若A能抑制水的电离,B能促 503589608
进水的电离,则化合物A的化学式为 ,B的化学式是 。
③Z与Y形成的稳定化合物的电子式为 。
④X与Y、X与M均可形成18电子分子,写出这两种分子在水溶液中反应生成M单质的化学方程式:
可观察到的实验现象是 。
16.(10分)在真空中将CuO和硫粉混合加热可生成S2O和固体A,1mol CuO反应电子转移数为1mol。
(1)写出上述反应的化学方程式: ;
(2)若将S2Cl2与CuO加热,在100-400℃时,也能生成S2O,试写出该反应的化学方程式:
;
(3)S2O在NaOH溶液中发生两种歧化反应,生成S2-、S2O42-、SO32-,请写出这两种歧化反应的离子反应方程式:
, ;
(4)S2O也能在水中发生歧化反应,生成两种酸,(两种酸酸性都不强)试写出上述反应的化学方程式:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com