
1、地球上最基本的生命系统是 ( )
A.细胞 B.组织 C.器官 D.系统
(五)由于△H与反应完成的物质的量有关,所以方程式前面的化学计量数必须与△H相对应。如果化学计量数加倍,则△H也要加倍。当反应逆向进行时,其焓变与正向进行时的焓变数值相等,但符号相反。
 [思考感悟]N2(g)+3H2(g) 2NH3(g) △H(298K)=-92.4kJ·mol-1,上述反应达到平衡后再加入N2,△H是否变化?
[思考感悟]N2(g)+3H2(g) 2NH3(g) △H(298K)=-92.4kJ·mol-1,上述反应达到平衡后再加入N2,△H是否变化?
平衡后加入N2,平衡右移,放出的能量增多,但△H为恒温、恒压下发生每摩反应的一个固定值,不会改变。
[基础训练]1、(多选)在101kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。已知C(石墨)、H2和CO的燃烧热分别为393.5kJ·mol-1、285.8kJ·mol-1和282.8kJ·mol-1。现有H2和CO组成的混合气体56.0L(标准状况),经充分燃烧后,放出总热量为710.0kJ,并生成液态水。下列热化学方程式或描述中,正确的是( CD )
A、2CO(g)+O2(g)=2CO2(g) △H=+282.8kJ·mol-1
B、2H2(g)+O2(g)=2H2O(g) △H=-571.6kJ·mol-1
C、C(石墨)+1/2O2(g)=CO(g) △H=-110.7kJ·mol-1
D、燃烧前混合气体中,H2的体积分数为40%
2、NH3(g)燃烧的产物是NO2(g)和H2O(g)。已知反应有:
1H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1,
21/2N2(g)+O2(g)=NO2(g) △H=33.9kJ·mol-1,
3NH3(g)=1/2N2(g)+3/2H2(g) △H=46.0kJ·mol-1。
下列关于NH3(g)燃烧的热化学方程式的书写正确的是( A )
A、NH3(g)+7/4O2(g)=NO2(g)+3/2H2O(g) △H=-282.8kJ·mol-1
B、NH3(g)+5/4O2(g)=NO2(g)+3/2H2O(g) △H=-161.9kJ·mol-1
C、NH3(g)+7/4O2(g)=NO2(g)+3/2H2O(g) △H=-161.9kJ·mol-1
D、NH3(g)+5/4O2(g)=NO2(g)+3/2H2O(g) △H=-282.8kJ·mol-1
3、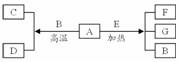 A-G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体。已知A(s)+B(g)=C(g)+D(g) △H=+131.4kJ·mol-1,某同学实验测知,4gA发生上述反应吸收43.8kJ的热量。
A-G是中学化学常见物质,A、D为单质,G是含A元素的酸性气体。已知A(s)+B(g)=C(g)+D(g) △H=+131.4kJ·mol-1,某同学实验测知,4gA发生上述反应吸收43.8kJ的热量。
(1)写出A元素的名称:碳。
(2)另外知:A(s)+O2(g)=G(g) △H=-393.6kJ·mol-1,
C(g)+1/2O2(g)=G(g) △H=-283kJ·mol-1,D(g)+1/2O2(g)=B(g) △H=-242kJ·mol-1。
由此判断“因为283kJ·mol-1+242kJ·mol-1>393.6kJ·mol-1,所以A燃烧时加少量B可以放出更多的热量”这种说法是否正确?并说明理由:不正确,因为1molA与O2直接燃烧放出的热量为393.6kJ,1molA先与B反应生成C和D,C和D再与O2反应,共放热-131.4kJ+283kJ+242kJ=393.6kJ,两者相同。
(3)写出A+O2→C的热化学方程式:C(s)+1/2O2(g)=CO(g) △H=-110.6kJ·mol-1。
[高考模拟]4、(2007全国卷Ⅱ)已知:①1 mol H2分子中化学键断裂时需要吸收436kJ的能量;②1 mol Cl2分子中化学键断裂时需要吸收243kJ的能量;③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量。下列叙述正确的是( C )
A、氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
B、氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183kJ/mol
C.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=-183kJ/mol
D.氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183kJ/mol
5、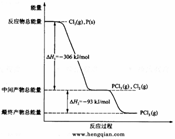 (2008全国卷Ⅱ26)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
(2008全国卷Ⅱ26)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是P(s)+3/2Cl2(g)=PCl3(g) △H=-306kJ·mol-1;
(2)PCl5分解成PCl3和Cl2的热化学方程式是PCl5(g)=PCl3(g)+Cl2(g) △H=+93kJ·mol-1;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80molPCl5,反应达平衡时,PCl5还剩0.60mol,其分解率α1等于25%;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2。α2大于α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是因为这两个反应都是放热反应,先生成PCl3,再降温后生成PCl5,有利于提高转化率,防止产物分解。
(4)P和Cl2分两步反应生成1mol PCl5的△H3为-399kJ·mol-1。P和Cl2一步反应生成1molPCl5的△H4等于△H3(填“大于”“小于”或“等于”);
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是PCl5+4H2O=H3PO4+5HCl。
(四)△H只能写在化学方程式的右边,若为放热反应,则△H为“-”;若为吸热反应,则△H为“+”。其单位一般为kJ·mol-1,其真正含义是指化学方程式中的物质的物质的量用“mol”来衡量时,所对应的能量变化是多少千焦。并不是特指“1mol物质参加反应时,放出或吸收的热量”。
(二)注意热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数。因此其化学计量数可以是整数,也可以是分数。
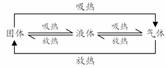 (三)反应物和产物的聚集状态不同,焓变的数值和符号就可能不同。因此,必须注明物质的聚集状态(s、l、g),水溶液则用aq表示。这样才能完整地体现出热化学方程式的意义。热化学方程式中不用标“↑”和“↓”。物质状态变化时的能量变化关系如图:
(三)反应物和产物的聚集状态不同,焓变的数值和符号就可能不同。因此,必须注明物质的聚集状态(s、l、g),水溶液则用aq表示。这样才能完整地体现出热化学方程式的意义。热化学方程式中不用标“↑”和“↓”。物质状态变化时的能量变化关系如图:
(一)焓变与温度和压强等测定条件有关,所以书写必须注明反应的温度和压强(若为298K、101kPa时,可不注明)。
书写热化学方程式时除了要遵循普通化学方程式的书写要求外,还应注意以下五点:
20. he is such a lazy man ______ nobody wants to work with_____.
A. as; him B. that; / C. as; / D. whom; him
19. The man said that the car ____ day after day by him for ten years by the end of next year.
A. would be driven B. would be driving
C. would have been driven D. would have been driving
18. ________ in the town,I would leave for the countryside. A. By staying B. Than stay
C. Rather than stay D. To stay
17. The author wishes to call our attention to the fact ____ the medical services and efficiency are not satisfactory at the moment.
A. what B. whether C. that D. which
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com