
1.下列物质加入水中显著放热的是
A.固体NaOH B.生石灰 C.无水乙醇 D.固体NH4NO3
[例1] 下列说法正确的是
A.需要加热方能发生的反应一定是吸热反应
B.放热的反应在常温下一定很容易发生
C.反应是放热还是吸热,由反应物的总能量和生成物的总能量的相对大小决定
D.放热反应中只有放热过程没有吸热过程
[例2]在同温同压下,下列各组热化学方程式中,△H1>△H2的是
A.2H2(g)+O2(g)==2H2O(g);△H1 2H2(g)+O2(g)==2H2O(l);△H2
B.S(g)+O2(g)==SO2(g);△H1 S(s)+O2(g)==SO2(g);△H2
C.C(s)+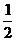 O2(g)==CO(g);△H1
C(s)+O2(g)==CO2
(g);△H2
O2(g)==CO(g);△H1
C(s)+O2(g)==CO2
(g);△H2
D.H2(g)+Cl2(g)==2HCl(g);△H1
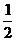 H2(g)+
H2(g)+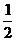 Cl2(g)==HCl(g);△H2
Cl2(g)==HCl(g);△H2
[例3]由氢气和氧气反应生成1mol水蒸气放热241.8kJ。写出该反应的热化学方程式:_______________。若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g)+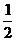 O2(g)=H2O(1) 的△H=
,氢气的燃烧热为 。
O2(g)=H2O(1) 的△H=
,氢气的燃烧热为 。
[例4]化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
|
化学键 |
P-P |
P-O |
O=O |
P=O |
|
键能/
kJ·mol–1 |
197 |
360 |
499 |
X |
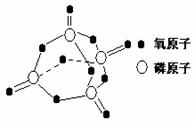
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如上图所示,则上表中X= 。
10.中和热的测定
9.化石燃料的利弊、新能源的开发
8.关于反应热的简单计算、盖斯定律
7.热化学方程式
⑴ 含义:表明反应所放出或吸收的热量的化学方程式。热化学方程式不仅表明化学反应中物质的变化同时也表明化学反应中的能量变化。
⑵ 书写:
① 注明反应时的 和 (常温常压不需注明)。
② 注明反应中各物质的聚集状态(若为同素异形体要注明名称)。物质的状态不同,能量不同,反应中的热效应不同。
③ 注明“ΔH”的“+”与“-”。“+”表示该反应吸热,“-”表示该反应放热。
④ 热化学方程式中各物质化学式前的化学计量数只表示物质的量,不表示分子个数。可以是整数也可以是分数。相同物质的同一化学反应,当化学计量数改变时,其ΔH也同等倍数的改变。
6.中和热:在 中,酸碱发生中和反应生成 H2O时的反应热叫中和热。单位:kJ/mol。强酸强碱的中和热为:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol。
5.燃烧热:在 kPa时, 物质完全燃烧生成 时所放出的热量,叫做该物质的燃烧热。单位: 。
4.放热反应:例如,燃烧、中和反应,金属的氧化,铝热反应,较活泼金属与酸的反应,由不稳定物质转化为稳定物质
吸热反应:弱电解质的电离、盐类的水解,C和CO2的反应,加热分解反应,Ba(OH)2•8H2O与NH4Cl的反应,由稳定物质转化为不稳定物质
3.反应热与化学键键能的关系:化学反应的本质是旧化学键断裂,新化学键生成的过程。断开化学键吸收能量,生成化学键释放能量。△H=反应物的键能总和-生成物的键能总和。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com