
5.下表反映了1978-2008年我国城乡居民家庭恩格尔系数的变化情况
|
年份(年) |
1978 |
1990 |
1995 |
2002 |
2007 |
2008 |
|
农村家庭恩格尔系数(%) |
67.7 |
58.8 |
58.6 |
46.2 |
43.1 |
43.7 |
|
城镇家庭恩格尔系数(%) |
57.5 |
54.2 |
50.1 |
37.7 |
36.3 |
37.9 |
表格说明,改革开放以来( )
①我国城乡居民的生活水平显著提高
②我国城乡居民的消费心理不断发生变化
③我国城乡居民的消费结构不断改善
④我国的物价水平持续下跌
A.①③ B.②③ C.①② D.①④
[解析]选A。恩格尔系数是指食品支出占家庭总支出的比重。恩格尔系数减小,表明人民生活水平提高,消费结构改善,由此可以判断①③正确。
4.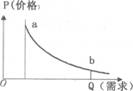 价格是市场的信号灯,价格变化对人们的生活和生产带来深远影响。在假定其他因素不变的情况下,价格与需求的关系可以用右图表示。右图需求曲线对生产者的启示是( )
价格是市场的信号灯,价格变化对人们的生活和生产带来深远影响。在假定其他因素不变的情况下,价格与需求的关系可以用右图表示。右图需求曲线对生产者的启示是( )
A.减少商品生产,控制需求从而获得高额利润
B.提高劳动生产率,降低成本和价格,扩大市场份额
C.迎合消费者需要,生产高质量的商品
D.以市场需求为导向,加快产品结构的调整
[解析]选B。面对低价竞争,生产者应提高劳动生产率,降低生产成本。ACD与需求曲线不符。
3.2009年10月12日,国务院总理温家宝主持召开国务院常务会议,分析农业生产形势,研究部署做好秋冬种工作。会议决定,明年小麦各品种最低收购价每市斤均提高3分钱,其中,白小麦每市斤提高到0.9元,红麦和混合麦每市斤提高到0.86元。同时适当提高稻谷特别是优质稻最低收购价格。上述做法( )
①有利于扩大农村小麦的生产规模
②说明小麦生产供不应求
③说明价格是调节供求关系和实现资源合理配置的重要机制
④说明商品价格主要是由国家决定
A.①② B.②④ C.③④ D.①③
[解析]选D。国家提高小麦最低收购价,目的在于稳定小麦市场的价格,保护种粮农民的利益,这一做法可以调节生产规模,体现了利用价格调节供求关系的道理,故应选①③。②与事实不符,④观点错误,商品价格主要是由市场决定的。
2.中国人民银行授权中国外汇交易中心公布,2009年10月12日银行间外汇市场美元对人民币汇率中间价为l美元兑换人民币6.8275元,2008年1月28日为1美元兑换人民币7.1996元。上述汇率变化有利于( )
①我国出口贸易的发展
②我国进口贸易的发展
③我国对外投资的增加
④吸引外商在我国投资
A.①② B.①③ C.②③ D.③④
[解析]选C。人民币升值会使人民币在国际市场上的购买力增加,美元在我国市场上的购买力下降。由此可知,人民币升值对我国来说,有利于进口而不利于出口;有利于我国对外投资,但不利于外商在我国投资,故②③正确。
1.假定某国在一年内,商品价格总额增长50%,货币流通次数增加20%,则该国1元纸币的购买力相当于原来 元的购买力。该国这一年中最可能出现的现象是 。( )
A.0.25 投资增加
B.1.25 物价上涨
C.0.25 投资减少
D.1.25 物价下跌
[解析]选D。假定商品的价格总额和货币流通次数都没有变化时,市场上需要的货币量是1,商品价格总额和货币流通次数都是1。当商品价格总额增长50%,变成了1×(1+50%)=1.5,货币流通次数增加20%,变成了1×(1+20%)=1.2,市场上需要的货币量=商品价格总额/货币流通次数,所以现在需要的货币量是1.5/1.2=1.25,也就是变化后市场上需要的货币量比原来多了。在本题中,该国并没有多发行货币,所以1元的购买力相当于原来1.25元的购买力,即货币升值。此时说明社会总供给大于社会总需求,社会将会出现通货紧缩现象,物价持续下跌,所以选D项。
6.根据中和热的测定实验填空。
取0.55 mol/L的NaOH溶液50mL与0.5mol/L的盐酸50mL置于图3-4所示的装置中进行反应和测定中和反应的反应热。
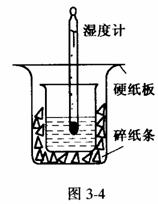
(1)图3-4装置的名称是____________,装置中缺少的一种仪器是____________,装置中还存在的错误有____________,这种错误会造成最高温度读数____________(填“增大”、“减小”或“无影响”)。
(2)大烧杯杯口若不盖硬纸板,测得的中和热的数值将____________(填“偏大”、“偏小”或“无影响”)。
(3)假定0.5mol/L的盐酸和0.55mol/L的NaOH溶液的密度都是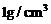 1,反应前的温度为18℃,反应后最高温度为t,则中和热的计算式是△H=________________________。
1,反应前的温度为18℃,反应后最高温度为t,则中和热的计算式是△H=________________________。
(4)实验中,若改用60mL 0.5mol/L的盐酸进行实验,与上述实验结果相比,则放出的热量____________(填“增多”、“减小”或“相等”),测得的中和热____________(填“相同”或“不相同”)。
(5)实验中,将盐酸倒入NaOH溶液中,或将NaOH溶液倒入盐酸中,对实验结果____________(填“有影响”或“无影响”)。该溶液快速混合好还是慢混合好?______________。理由是____________________________________。
测定中和热属于定量实验,定量实验要求准确而误差小,否则有可能产生错误的结论。
(1)量热计 环形玻璃搅拌棒 大烧杯杯口与小烧杯杯口没有相平,两烧杯之间没有塞满碎纸条 减小
(2)偏小 (3)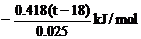 (4)增多 相同(5)无影响 快速好 因为慢速混合导致较多热量散失
(4)增多 相同(5)无影响 快速好 因为慢速混合导致较多热量散失
5.将4g甲烷和适量氧气混合后通入一密闭容器中,点燃使之恰好完全反应,待恢复到原温度后,测得反应前后压强分别为3.03×105Pa和1.01×105Pa,同时又测得反应共放出222.5kJ热量。试根据上述实验数据,写出该反应的热化学方程式。
4.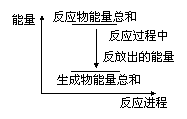 对于Zn(s)+H2SO4(l)=ZnSO4(l)+H2(g);ΔH <0的化学反应下列叙述不正确的是
对于Zn(s)+H2SO4(l)=ZnSO4(l)+H2(g);ΔH <0的化学反应下列叙述不正确的是
A.反应过程中能量关系可用右图表示
B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池锌为负极
D.若将其设计为原电池当有32.5g锌溶解时,正极放出
气体一定为11.2L
3.下列说法或表示方法正确的是
A.等量的硫蒸气和硫固体分别完全燃烧,前者放出热量多
B.在稀溶液中: H++OH-=H2O;△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ;
C.由C(石墨)→C(金刚石);△H=+119 kJ/mol 可知,金刚石比石墨稳定
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=+285.8kJ/mol
2.沼气是一种新能源,它的主要成分是甲烷。0.5 moLCH4完全燃烧生成CO2和H2O时,放出445 kJ热量,则下列热化学方程式中正确的是
A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l);△H=+890 kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=+890 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890 kJ/mol
D.1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l);△H=-890kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com