
22.(1)25℃时, 0.05mol/LH2SO4溶液的PH=_________;0.05mol/LBa(OH)2溶液PH=____ ___。
(2)已知100℃时,KW=1×10-12.在该温度下,将100ml0.001 mol/L的NaOH溶液加水稀释至1L,则该溶液的PH= 。 23.下列实验操作及实验结果处理正确的是 (填序号)。
A.用托盘天平称取5.5 g KCl固体
B.在酸碱中和滴定实验中,用20mL量筒量取20. 00 mL待测NaOH溶液
C.将干燥的pH试纸浸入某溶液一会儿后取出,与标准比色卡比较以测定该溶液pH
D.若用水润湿过的pH试纸去测pH相等的H2SO4和CH3COOH,则CH3COOH的误差更大
E.在进行中和热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、使用的酸碱正好反应,进行两到三次实验,取平均值。
21.在一定条件下,可逆反应:mA+nB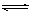 pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是 。
(2)A、C是气体,增加B的量,平衡不移动,则B为 态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是 。
(4)加热后,可使C的质量增加,则逆反应是 反应(放热或吸热)。
20.已知一种c(H+)=1×10-3mol/L的酸和一种c(OH-)=1×10-3mol/L的碱溶液等体积混合后溶液呈酸性,其原因可能是: ( )
A.浓的强酸和稀的强碱溶液反应
B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应
D.生成了一种强酸弱碱盐
第II卷 (40分)
19.下列说法正确的是 ( )
A.PH=2与PH=1的硝酸中c(H+)之比为1:10
B.Na2CO3溶液中c(Na+)与c(CO32-)之比为2:1
C.pH=2的HA溶液与pH=12的MOH溶液任意比混合:
c(H+) + c(M+)=c(OH-) + c(A-)
D.0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1
18.下列关于电解质溶液中离子关系的说法中正确的是 ( )
A.0.1mol/L的NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
B.0.1mol/L NH4Cl溶液中离子浓度关系:
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.常温下,在PH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存
D.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的PH=7,则混合液中:
c(Na+)=c(CH3COO-)
17.已知次氯酸是比碳酸还弱的酸,反应Cl2 + H2O 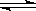 HCl
+ HClO达平衡后,要使HClO浓度增大,可加入 ( )
HCl
+ HClO达平衡后,要使HClO浓度增大,可加入 ( )
A.HCl B.少量Na2SO3 C.少量NaOH
D.CaCO3
16.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确的是 ( )
A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸
B.锥形瓶用蒸馏水洗净后,润洗后加入一定体积的未知浓度的NaOH溶液
C.滴定时,没有逐出滴定管下口的气泡
D.读数时,视线与滴定管内液体的凹液面最低处保持水平
15.能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是
( )
(1)将水加热煮沸 (2)向水中投入一小块金属钠 
(3)向水中通CO2
(4)向水中通NH3

(5)向水中加入明矾晶体 (6)向水中加入NaHCO3固体 
(7)向水中加NaHSO4固体
A.(1)(3)(6)(7)
B.(1)(3)(6) C.(5)(7) D.(5)
14.下列叙述正确的是( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2mol/L的盐酸,与等体积水混合后pH=1
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
12.反应C(S)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对反应速率几乎没有影响的是
( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对反应速率几乎没有影响的是
( )
A.增加C的量

B.将容器的体积缩小为一半
C.保持体积不变,充入氮气使体系的压强增大
D.保持压强不变,充入氮气使容器的体积增大
 13.有可逆反应mA(s)+nB(g)
13.有可逆反应mA(s)+nB(g) pC(g)+qD(g),反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图所示:
pC(g)+qD(g),反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图所示: 
根据图中曲线分析,判断下列叙述中,正确的是 ( )

A.到达平衡后,若使用催化剂,C的质量分数增大
B.平衡后,若升高温度,平衡则向逆反应方向移动
C.平衡后增大A的量,有利于提高A的转化率
D.化学方程式中一定

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com