
4.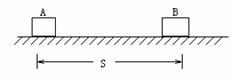 如图所示,A、B两物体在同一直线上运动,当它们相距7m时,A在水平拉力和摩擦力作用下,正以4m/s的速度匀速运动,两物体B此时的速度为10m/s,方向向右,它在摩擦力作用下做减速运动,加速度的大小为2m/s2,则A追上B用的时间为( )
如图所示,A、B两物体在同一直线上运动,当它们相距7m时,A在水平拉力和摩擦力作用下,正以4m/s的速度匀速运动,两物体B此时的速度为10m/s,方向向右,它在摩擦力作用下做减速运动,加速度的大小为2m/s2,则A追上B用的时间为( )
A. 6s B. 7s
C. 8s D. 9s
3.甲、乙两辆汽车沿平直公路从某地同时驶向同一目标,甲车在前一半时间内以速度v1做匀速运动,后一半时间内以速度v2做匀速运动;乙车在前一半路程中以速度v1做匀速运动,后一半路程中以速度v2做匀速运动,则( )
A. 甲先到达 B. 乙先到达 C. 甲、乙同时到达 D. 不能确定
2.物体做竖直上抛运动,在不计空气阻力的情况下,能达到的最大高度为h,所用时间为t,则物体上升到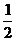 h所用时间和抛出时间为
h所用时间和抛出时间为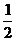 t时上升的高度分别是( )
t时上升的高度分别是( )
A. 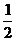 t,
t, 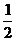 h B.
(1-
h B.
(1-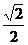 )t,
)t, 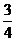 h
h
C. 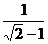 t,
t, 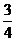 h D.
h D.
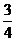 t,
t, 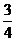 h
h
1.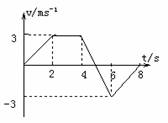 有一物体做直线运动,其速度一时间图象如图所示,则物体的加速度和速度方向相同的时间间隔是( )
有一物体做直线运动,其速度一时间图象如图所示,则物体的加速度和速度方向相同的时间间隔是( )
A. 只有0<t<2s
B. 只有2s<t<4s
C. 0<t<2s和6s<t<8s
D. 0<t<2s和5s<t<6s
(三)、计算题(共14分)
10、将等体积的4×10-3mol·L-1的AgNO3溶液和4×10-3mol·L-1的K2CrO4溶液混合,是否能析出Ag2CrO4沉淀?[已知Ksp (Ag2CrO4)=9.0×10-12mol3·L-3]
十:教学反思
人们常说:“兴趣是最好的老师”,本节课通过‘水垢、溶洞、钡餐、小朋友的蛀牙、含氟牙膏’等与学生的实际生活息息相关的例子和‘动画、实验演示、分组实验’等来创设教学情景,学生的兴致很高;在设计教学方案时,依据有效教学的5大原则,结合化学学科特点及学生的认知水平,对教材的体系作了适当改变。
对于理论课,过去老师都是直接给出结论,再通过实验验证,最后通过练习进行巩固。传统教法体现不了新课标要求。因此在设计时,首先想法提高学生的学习兴趣,然后通过类比提出预测,用实验进行探究,让学生在探究的基础上自己得出结论,而不是老师‘端’给学生。这节课由表及里,由易到难,一步一步地探讨沉淀溶解平衡及其应用的本质,有水到渠成的感觉。学生在课堂上积极讨论、发言,思路非常开放,充分调动了学生的积极性,无论是知识还是方法、人生观方面都有所收获。
本节的教学基本达到了预期的目的,但由于学生基础不同,分析、交流的时间较短,学生展示的机会还不易充分;内容较多,学生预习不够充分时,不易达到理想效果!
(二)、填空题(本题包括5小题,共56分)
6、(7分)铬酸银在298K时的溶解度为0.004545g,求其溶度积Ksp= 。(已知Ag2CrO4的相对分子质量为332)
7、(14分)FeS饱和溶液中存在如下平衡:FeS(s) Fe2++S2- Ksp=8.1×10-17 mol2·L-2
(1)理论上的FeS的溶解度为_______________。
(2)又知FeS饱和溶液中[H+]与[S2-]之间存在以下限量关系:[H+]2 [S2-]=1.0×10-22mol3·L-3,为了使饱和溶液里[Fe2+]达到1mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的[H+]为__________________________。
8、(14分)Cu(OH)2是难溶电解质,在水中存在着沉淀溶解平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq)。在常温下其溶度积常数Ksp=2×10-20mol3·L-3。则:
(1)某CuSO4溶液中,[Cu2+]=0.02 mol·L-1,在常温下如果要生成Cu(OH)2沉淀,需要向溶液中加入碱溶液来调整溶液的pH,使溶液pH大于 。
(2)要使0.2 mol·L-1CuSO4溶液中的Cu2+沉淀完全(Cu2+浓度降为原来的千分之一),则应向CuSO4溶液中加入烧碱使溶液pH大于 。
9、(21分)向AgI饱和溶液中分别加入些列物质,请就溶液中的I- 浓度的变化做出回答:
(1)加入少量AgNO3固体: ;
(2)加入少量AgI固体: ;
(3)加入少量AgBr固体: 。
(一)、选择题(30分)
1、有关AgCl沉淀的溶解平衡说法正确的是( )。
A、AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B、AgCl难溶于水,溶液中没有Ag+ 和Cl-
C、升高温度,AgCl的溶解度增大
D、向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变
2、向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡沉淀变为黄色,再滴入一滴Na2S溶液并振荡沉淀变为黑色。则三种沉淀的溶解度关系为 ()
A.AgCl=AgI=Ag2S B.AgCl>AgI>Ag2S
C.AgCl<AgI<Ag2S D.AgI>AgCl>Ag2S
3、在一定温度下,向PbI2饱和溶液中加水,下列叙述正确的是( )。
A.PbI2的溶解度增大 B.PbI2的溶解度、Ksp均不变
C.PbI2的Ksp增大 D.PbI2的溶解度、Ksp均增大
4.以MnO2为原料制得的MnCl2溶液中常含有Cu2+、 Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS可使这些金属离子转化为硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。可推知MnS具有的性质是( )
A.吸附性 B.溶解度等于CuS、PbS、CdS
C.溶解度大于CuS、PbS、CdS D.溶解度小于CuS、PbS、CdS
5、把氢氧化钙加入蒸馏水中,一定时间后达到如下平衡:
Ca(OH)2(s) Ca2+(aq) + 2OH-(aq)加入以下溶液,可使Ca(OH)2固体的量减少的是( )。
A. Na2S溶液 B. AlCl3溶液
C. NaOH溶液 D. CaCl2溶液
4.沉淀转化的应用:沉淀的转化在科研和生产中具有重要的应用价值。
(1)污水重金属离子的处理。
(2)在分析化学中的应用
(3)对一些自然现象的解释
3、解决沉淀溶解平衡问题的基本思路:
“看到”微粒--“找到”平衡--“想到”移动
2、 沉淀转化的规律
a.一般来说,溶解能力相对较强的物质易转化为溶解能力相对较弱的物质。
b. 当两种难溶物溶解能力差别不大时, 溶解能力相对较弱的物质在一定条件下能转化为溶解能力相对较强的物质。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com