
4.某凸透镜焦距10 cm,若用来观察昆虫的绒毛,应将昆虫放置在__________,用做投影仪的镜头应放置在__________,用做照相机的镜头应放置于__________.
会做上述题目是学习本节课的基础.
3.当物体离凸透镜_______________时,成缩小的实像,此时用途如照相机.
2.当物体离凸透镜__________时,成放大的虚像,此时用做放大镜.
1.投影仪是根据透镜成放大实像原理制成,当物体离凸透镜__________时成放大实像.
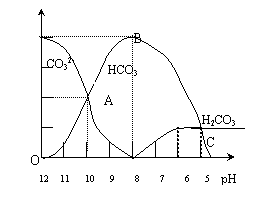
28.常温下在20mL0.1mol/LNa2CO3
溶液中逐滴加入0.1mol/L HCl溶液40mL,
溶液的pH逐渐降低,此时溶液中含碳元
素的微粒物质的量浓度的百分含量(纵轴)
也发生变化(CO2因逸出未画出),如下
图所示。回答下列问题:
(1)20mL 0.1mol/LNa2CO3溶液呈碱性的原因是
(用离子方程式表示): ;
其溶液中所有阳离子和阴离子的浓度有何关系?
(用等式表示) 。
(2)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确 。
(3)当加入盐酸使溶液PH为10时,混合液中含碳元素的离子有哪些? ,其物质的量之比为 。
(4)请写出OAB段的离子方程式 ;
当混合液的pH= 时,开始放出CO2气体。
27.某化学研究性学习小组在研讨Fe3+和SO32-之间发生的反应时形成了两种观点。一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生水解反应:2Fe3++3SO32-+3H2O=2Fe(OH)3↓+3SO2↑。为了验证这两种观点的正确性,同学们设计并实施了下列实验,请你参与并协助完成相关学习任务。
[实验探究]
(1)先向试管中注入3mL Na2SO3浓溶液,然后加入少量BaCl2溶液,有白色沉淀生成,再加入少量稀盐酸,生成的沉淀完全溶解并有无色气体产生。这一实验目的是__________ 。
(2)向试管中加入3mL FeCl3浓溶液,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,继续加入Na2SO3浓溶液,溶液颜色加深,最终变为红褐色(整个过程中无气体或沉淀产生)。向该红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是____________________;此时,再向试管中加入BaCl2溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式_______________。
(3)将FeCl3浓溶液和Na2SO3浓溶液稀释后重复实验(2)的操作。实验现象基本相同。由上述实验可以得出的结论是___________________。
[问题讨论]
(4)如果在FeCl3浓溶液中加入Na2CO3浓溶液,能观察到生成红褐色沉淀和无色气体的现象,该反应的离子方程式是_________________。
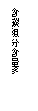
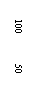
 (5)Na2SO3和Na2CO3分别与氯化铁溶液反应的现象不同,可能的原因是____________。
(5)Na2SO3和Na2CO3分别与氯化铁溶液反应的现象不同,可能的原因是____________。
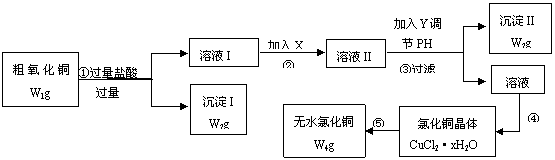
26.某化学研究性学习小组拟采用粗氧化铜(含少量氧化亚铁及不溶于酸的杂质)制取无水氯化铜并测定样品中氧化铜的质量分数,其实验流程如图所示:
实验过程中的pH调节为:
 物质 开始沉淀时的pH
完全测定时的pH
物质 开始沉淀时的pH
完全测定时的pH

Fe(OH)3 2.7 3.7
 Fe(OH)2 7.6
9.6
Fe(OH)2 7.6
9.6
 Cu(OH)2 5.2
6.4
Cu(OH)2 5.2
6.4

请回答以下问题:
(1)步骤①、③过滤操作中,除用到仪器:铁架台(带铁圈)、漏斗、烧杯除外,还需要使用的仪器用品有_________。
(2)步骤①中发生的离子反应方程式为_______________。(3)步骤②溶液Ⅰ中加入试剂X是_______(填下列试剂的编号),其目的是_______。
a、氢氧化钠 b、氯水 c、碱式碳酸铜 d、氧化铜
(4)步骤③中将溶液pH调节到的范围是___________[选填问题(3)所给试剂的编号],选择这种试剂的原因是________。
(5)步骤⑤要得到无水氯化铜,需要在干燥的HCl气流中加热CuCl2·xH2O,其原因是_______________。
(6)经检测,CuCl2·xH2O中含水28.6%,则CuCl2·xH2O中x的值为________。
(7)若步骤④中80%的氯化铜转入晶体,其余各步转化都是完全的,请根据流程图中表示的质量数据,写出样品中氧化铜质量分数的计算式。
25.若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反映:a、甲+H2O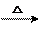 乙+丙b、乙
乙+丙b、乙 氧化物+H2O
氧化物+H2O
(1)若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化生成的氧化物为红棕色粉末,则该金属在周期表中的位置是_________。
(2)若甲为某短周期金属元素的氧化物,则甲发生a反应的化学方程式为________________。
 (3)将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则反击发生的电极反应为___________。
(3)将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则反击发生的电极反应为___________。
24. 25℃时,体积为Va、pH=α的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液混合后恰好完全反应。若Va>Vb,且α=0.4b,
请填写下列空白:
(1)a可否等于2?(填“可”或“否”)_________;理由是:
(2)a可否等于4?(填“可”或“否”)_____________;理由是:
_________________________________________________________
(3)a的取值范围是__________________________。
23.某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,则该温度下水的Kw= 。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
(1)若所得混合液为中性,且a=12,b=2,则Va︰Vb= 。
(2)若所得混合液为中性,且a+b=12,则Va︰Vb= 。
(3)若所得混合液的pH=10,且a=12,b=2,则Va︰Vb= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com