
2.钠的化学性质
钠原子最外层只有一个电子,在化学反应中钠原子容易失去最外层的一个电子,具有很强的还原性,是一种活泼的金属元素。
(1)跟非金属反应:
①金属钠放置在空气中,会迅速被氧化而生成氧化钠:4Na+O2=2Na2O,(空气中钠的切面变暗)
②在空气(或氧气)中燃烧:2Na+O2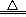 Na2O2(黄色火焰),以上反应说明Na2O2比Na2O稳定。可见,与O2反应时因条件不同而产物不同。
Na2O2(黄色火焰),以上反应说明Na2O2比Na2O稳定。可见,与O2反应时因条件不同而产物不同。
③在氯气中燃烧:2Na+Cl2  NaCl(白烟)
NaCl(白烟)
(2)钠与水反应:2Na+2H2O =2NaOH +H2 ↑
现象: ①浮:钠投入水中并浮在水面上 ②声:钠立即跟水反应,并放出热量,发出嘶嘶响声,产生气体。③游:同时钠熔成一个闪亮的小球并在水面上向各方迅速游动最后消失④红:反应后的水溶液使酚酞变红。
(3)钠与酸反应:钠与酸的反应比水反应更激烈,极易爆炸。
(4)钠与盐溶液反应:先考虑钠与水反应生成NaOH,再考虑NaOH是否与盐反应。
例如:①钠与CuSO4溶液反应
2Na+2H2O=NaOH+H2↑ (1)
CuSO4+2NaOH=Na2SO4+Cu(OH)2 (2)
合并(1)(2)得:2Na+2H2O+CuSO4=Na2SO4 +Cu(OH)2↓+H2 ↑
②钠与FeCl3溶液反应:6Na+6H2O+2FeCl3=6NaCl+2Fe(OH)3↓+3H2↑
1.钠的物理性质
金属钠是一种柔软 ,银白色、有金属光泽的金属,是热和电的良导体;它的密度为0.97g/cm3,比水的密度小,比煤油的密度大,熔点为97.81℃、沸点为882.9℃。
5.常见某些元素的特性
(1)与水反应的最激烈的非金属元素是氟;
(2)与水反应的最激烈的金属元素是铯;
(3)单质硬度最大的元素是碳;
(4)常温下有颜色的气体单质是氟气和氯气;
(5)稀有气体元素中原子半径最大的是氡;
(6)原子半径最小(大)的元素是氢(铯)(稀有气体除外);
(7)所形成的气态氢化物最稳定的元素是氟;
(8)正负化合价的代数和为零,且气态氢化物中含氢百分率最高的元素是碳;
(9)最高价氧化物对应的水化物酸性最强的是氯;
(10)所形成的化合物种类最多的是碳;
(11)原子序数、电子层数、未成对电子数三者均相等的是氢
(12)只有负价并无正价的是氟;
(13)最轻的金属是锂;
(14)最轻的气体是氢气;
(15)同位素之一的原子核中只有质子没有中子的元素是氢;
(16)最高价氧化物及其水化物具有两性的元素是铝;
(17)空气中含量最多的元素,或气态氢化物的水溶液呈碱性的元素是氮;
(18)地壳中含量最多的元素,或气态氢化物的沸点最高的元素,或氢化物在通常情况下呈液态的元素是氧;3.(地壳组成中含量最高的前5种元素 O,Si,Al,Fe,Ca,)
(19)地壳中含量最多的金属元素是铝;
(20)最活泼的非金属元素,或无正价的元素,或无含氧酸的非金属元素,或无氧酸(气态氢化物)可以腐蚀玻璃的元素,或气态氢化物最稳定的元素,或阴离子的还原性最弱的元素是氟;
(21)最易着火的非金属元素的单质,其元素是磷;
(22)常温下单质呈液态的非金属元素是溴,金属元素是汞;
(23)元素的气态氢化物和它的最高价氧化物对应的水化物起化合反应的元素是氮;
(24)元素的单质在常温下能与水反应放出气体的短周期元素是锂、钠、氟;
(25)常见的能形成同素异形体的元素有碳、磷、氧、硫。
(26)与He原子电子层结构相同的离子有(2电子结构):H-、Li+、Be2+ (27)与Ne原子电子层结构相同的离子有(10电子结构):F-、O2-、N3-、Na+、Mg2+、Al3+ (28)10电子的分子、离子有:CH4、NH3、H2O、HF、Ne、OH-、H3O+、 NH4+ F-、O2-、N3-、Na+、Mg2+、Al3+。
3.对角线规则的应用:在元素周期表中,某些主族元素与右下方的主族元素的性质有些相似,被称为“对角线规则”.

实例:①锂与镁的相似性超过了它和钠的相似性,如:LiOH为中强碱Li2CO3难溶于水等等。
②Be、Al的单质、氧化物、氢氧化物均表现出明显的“两性”;Be 和Al单质在常温下均能被浓H2S04钝化;A1C13和BeCl2均为共价化合物等。
③晶体硼与晶体硅一样,属于坚硬难熔的原子晶体。
请用这些元素的电负性解释对角线规则。
2.启发人们在一定范围内寻找某些物质
(1)半导体元素在两性线附近,如:Si、Ge、Ga等。
(2)农药中常用元素在右上方,如:F、Cl、S、P、As等。
(3)催化剂和耐高温、耐腐蚀合金材料、主要在过渡元素中找。如:Fe、Ni、Rh、Pt、Pd等。
1.根据原子结构、元素性质及表中位置的关系预测元素的性质
(1)比较同主族元素的金属性、非金属性、最高价氧化物水化物的酸、碱性、氢化物的稳定性等。如:碱性:Ra(OH)2>Ba(OH)2;气态氢化物稳定性:CH4>SiH4
(2)比较同周期元素及其化合物的性质。如:酸性:HClO4>H2SO4;稳定性:HCl>H2S
(3)比较不同周期、不同主族元素性质时,要找出参照物。例如:比较氢氧化镁和氢氧化钾的碱性,可以把氢氧化钠作为参照物得出氢氧化钾的碱性强于氢氧化镁。
(4)推断一些未学过的元素的某些性质。如:根据ⅡA族的Ca(OH)2微溶,Mg(OH)2难溶,可以推知Be(OH)2更难溶。
4、电负性:用来表示当两个不同原子在形成化学键时吸引电子能力的相对强弱。
① 元素电负性数值的大小可用于衡量元素的金属性、非金属性的强弱。
一般认为,电负性大于1.8的元素为非金属元素,电负性小于1.8的是金属元素,而位于非金属三角区边界的“类金属”的电负性则在1.8左右,他们既有金属性又有非金属性。电负性最大的是F元素,电负性最小的是金属元素Cs。
实例:请指出下列化合物中化合价为正值的元素。
CH4 NaH NF3
② 元素电负性差值大小可用于衡量化合物的离子化程度。
一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子化合物;如果两个成键元素间的电负性差值小于1.7,它们之间通常形成共价化合物。
请查阅下列化合物中元素的电负性数值,判断它们哪些是离子化合物,哪些是共价化合物。
NaF HCl NO MgO KCl CH4
共价化合物: 离子化合物:
3、第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能(用I1表示)。+1价正离子再失去一个电子所需能量称为第二电离能,依次类推。
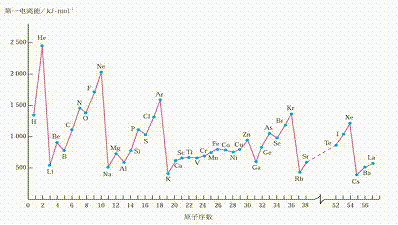
①同一种元素的逐级电离能的大小关系:I1<I2<I3<I4<I5……
②同一种元素的逐级电离能差值越大,越容易形成稳定的价态。
实例: Mg的I1和I2相差不多,而I2比I3小很多,所以Mg容易失去两个电子形成十2价离子。
③第一电离能是元素的金属活泼性的衡量尺度。
电离能大小反映了原子失去电子的难易。元素的第一电离能越小表示其越容易失去电子,即该金属的金属性越强。
④电离能的大小取决于原子的有效核电荷、原子半径以及原子的电子层结构。
主族元素的明显增加;副族元素的增高缓慢;半充满、全充满、全空状态稳定,电离能较高。注意:Be. N. Mg. P反常。
实例:为什么Be的第一电离能大于B ?
Be有价电子排布为2s2,是全充满结构,比较稳定,而B的价电子排布为2s22p1,、比Be不稳定,因此失去第一个电子B比Be容易,第一电离能小。
2、元素的金属性或非金属性强弱的判断
 ①与水反应置换氢的难易
①与水反应置换氢的难易
②最高价氧化物的水化物碱性强弱
 金属性强弱 ③单质的还原性或离子的氧化性(电解中在阴极上得电子的先后)
金属性强弱 ③单质的还原性或离子的氧化性(电解中在阴极上得电子的先后)
④互相置换反应(金属活动性顺序表)
依据: ⑤原电池反应中正负极(负极活泼)
⑥一般来说,元素第一电离能越小,电负性越小,则其金属性越强
 ①与H2化合的难易及氢化物的稳定性
①与H2化合的难易及氢化物的稳定性
非金属性强弱 ②最高价氧化物的水化物酸性强弱
③单质的氧化性或离子的还原性
④互相置换反应
⑤一般来说元素第一电离能越大,电负性越大,其非金属性越强
金属活动性顺序表:K>Ca>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au
例1:同周期的X、Y、Z三种元素,已知其氢化物分别为XH3、H2Y、HZ,则下列判断正确的是( B )
A.原子半径 Z > Y > X
B.Z的非金属性最强
C.氢化物还原性XH3 > H2Y > HZ,稳定性XH3 > H2Y > HZ
D.最高氧化物对应水化物H3XO4酸性最强
7、稀有气体元素的原子半径大于同周期元素原子半径。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com