
4.氧在化合物中一般显-2价,氢显+1价,但Na2O2 、H202中的氧显-1价,NaH、CaH2中的氢显-1价。
3.酸式盐的溶解度一般大于正盐,但溶解度NaHC03<Na2C03。
2.碱金属中,从Li至Cs,密度呈增大的趋势,但ρ(K)=0.862g/cm3<p(Na)=0.971e/cm3。
1.Na、K需保存于煤油中,但Li的密度比煤油小,所以Li必须保存在密度更小的石蜡油中或密封于石蜡
1.金属钠露置在空气中的变化过程:
银白色金属钠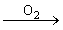



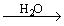


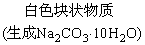
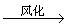
 2.Na2CO3与盐酸的互滴反应
(1)向盐酸里逐渐滴加入Na2CO3溶液(开始时酸过量)开始就有气体放出;
(2)向Na2CO3溶液里逐滴加入盐酸(开始时酸不足)开始无气体产生:
HCl+Na2CO3=NaCl+NaHCO3(无气泡)
HCl+NaHCO3=NaCl+CO2↑+H2O
可见不同的滴加顺序产生不同的现象,利用这种现象不用其他试剂就可鉴别Na2CO3溶液和盐酸。
3.碳酸氢钠和碳酸钠的制法
2.Na2CO3与盐酸的互滴反应
(1)向盐酸里逐渐滴加入Na2CO3溶液(开始时酸过量)开始就有气体放出;
(2)向Na2CO3溶液里逐滴加入盐酸(开始时酸不足)开始无气体产生:
HCl+Na2CO3=NaCl+NaHCO3(无气泡)
HCl+NaHCO3=NaCl+CO2↑+H2O
可见不同的滴加顺序产生不同的现象,利用这种现象不用其他试剂就可鉴别Na2CO3溶液和盐酸。
3.碳酸氢钠和碳酸钠的制法
(1)制取NaHCO3的方法
①减压低温蒸干NaHCO3溶液。NaHCO3遇热易分解,其水溶液加热更易分解,所以不可能采用常压下蒸发溶剂的方法制得NaHCO3晶体。
②往饱和Na2CO3溶液中通入CO2,过滤得到晶体。
Na2CO3+C02+H2O=2NaHCO3
(2)制取Na2CO3的方法
往饱和食盐水中依次通人足量的NH3、CO2(氨碱法),利用NaHCO3的溶解性小于NH4HCO3的溶解性原理,使NaHCO3从溶液中析出(依次通人CO2、NH3至饱和行吗?):
NH3+H2O+CO2=NH4HCO3
NH4HCO3 +NaCl=NaHCO3↓+NH4Cl[(制纯碱的
2NaHCO3 Na2CO3 +CO2↑+H2O(工业方法)
Na2CO3 +CO2↑+H2O(工业方法)
3.钠的其它重要化合物 (1)硫酸钠
Na2SO4·10H2O,俗名:芒硝,为无色晶体。
硫酸钠用途:制玻璃、造纸、染色、纺织、制水玻璃,在医药上用作缓泻剂等。
硫酸钠分布:盐湖、海水及矿物中。
(2)氢氧化钠,氢氧化钠为白色固体,极易溶于水(并放出大量热),易吸水而发生潮解,在空气中还易变质,反应为:2NaOH+CO2=Na2CO3+H2O。
俗名:苛性钠、烧碱、火碱,氢氧化钠有很强腐蚀性,它是一种重要的碱,具有碱的通性。工业制法:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑,
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 保存:密封保存。试剂瓶不能用玻璃塞,应用橡皮塞。因为烧碱能与玻璃成分中的SiO2发生反应:SiO2+2NaOH=Na2SiO3+H2O,生成的Na2SiO3使玻璃塞与瓶口粘结。
2.碳酸钠与碳酸氢钠
|
化学式 |
Na2CO3 |
Na2CO3·10H2O |
NaHCO3 |
|
俗 名 |
纯碱、苏打 |
- |
小苏打 |
|
溶解性 |
易溶于水 |
易溶于水(溶解度较Na2CO3小) |
|
|
色 态 |
白色粉末 |
无色晶体 |
细小白色晶体 |
|
热稳定性 |
稳定 |
易失水、风化 |
受热易分解2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
|
H+ |
CO32-+2H+=CO2↑+H2O较快,分步进行 |
HCO3-+H+=CO2↑+H2O
剧烈 |
|
|
NaOH |
不反应 |
HCO3-+OH-=CO32-+H2O |
|
|
石灰水 |
CO32-+Ca2+=CaCO3↓ |
石灰水足量:
HCO3-+Ca2++OH-=CaCO3↓+H2O
石灰水不足:
2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- |
|
|
BaCl2 |
CO32-+Ba2+=BaCO3↓ |
不反应(若再加NaOH,则有沉淀) |
|
|
CO2 |
NaCO3+CO2+H2O=2NaHCO3 |
不反应 |
|
|
用途 |
用于玻璃、肥皂、造纸、纺织等工业,洗涤 |
发酵剂、灭火器,医疗上用于治胃酸过多 |
|
|
转化 |
 |
1.氧化钠和过氧化钠的比较
|
比较内容 |
Na2O |
Na2O2 |
|
颜色、状态 |
白色固体 |
淡黄色固体 |
|
氧的化合价 |
-2价 |
-1价(过氧离子O22-) |
|
电子式 |
 |
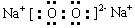 |
|
稳定性 |
较不稳定 |
较稳定 |
|
生成条件 |
通过钠的常温氧化生成 |
通过钠的燃烧生成 |
|
物质类别 |
碱性氧化物 |
过氧化物(不是碱性氧化物) |
|
与水反应 |
Na2O
+ H2O==2NaOH |
2Na2O2 + 2H2O==4NaOH + O2↑ |
|
与CO2反应 |
Na2O + CO2==Na2CO3 |
2Na2O2
+ 2CO2==2Na2CO3 + O2 |
|
与盐酸反应 |
Na2O +
2HCl==2NaCl + H2O |
2Na2O2 +
4HCl==4NaCl + 2H2O + O2↑ |
|
用途 |
用于少量Na2O2制取 |
强氧化剂、漂白剂、供氧剂 |
|
保存 |
密封保存 |
密封保存 |
4.钠的存在与用途
自然界中钠只能以化合态的形态存在,主要以氯化钠的形式存在。钠是一种强还原剂,工业上用它还原金属钛、锆、铌等;反应如:4Na+TiCl4(熔融)=Ti+4NaCl,另外钠和钾的合金在常温下呈液态,是原子反应堆的导热剂;钠也可用于制高压钠灯。
3.钠的存放和取用
由于金属钠的化学性质非常活泼,易与空气中的O2、H2O等反应,所以少量金属钠可保存在煤油里,大量的金属钠则存在铁筒中用石蜡密封。取用时一般先用镊子把钠从煤油中夹出来,并用滤纸把表面的煤油吸干,然后用小刀切下绿豆大小的一块再做有关实验。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com