
2.氧化铝
氧化铝白色固体,高熔点(2045℃),难溶于水,是两性氧化物(既能与酸反应生成盐和水,又能和碱反应时生成盐和水的氧化物),反应为Al2O3+6H+=2Al3++3H2O,Al2O3+2OH-+3 H2O=2[Al(OH)4]-
1.铝
铝为银白色金属,熔点为660.40C,沸点为24670C密度为2.7g·cm-3,导电性仅次于银、铜和金。
(1)铝跟非金属反应
常温下,铝被空气里的氧气氧化,在表面生成一层致密的氧化物薄膜,阻止内部的金属继续与氧气反应。铝在空气中强热:4Al+3O2 2Al2O3(反应放出大量的热和耀眼的白光,因此铝可用于制造燃烧弹、信号弹、火箭推进剂等。铝与氮气在高温下反应:2Al+N2
2Al2O3(反应放出大量的热和耀眼的白光,因此铝可用于制造燃烧弹、信号弹、火箭推进剂等。铝与氮气在高温下反应:2Al+N2 2AlN ,铝容易和卤素反应,常温下和氯气激烈化合生成三氯化铝;在溴中燃烧铝粉生成三溴化铝。在高温下也能和硫、氮气、碳直接化合成Al2S3、AlN、Al4C3(2000℃)。
2AlN ,铝容易和卤素反应,常温下和氯气激烈化合生成三氯化铝;在溴中燃烧铝粉生成三溴化铝。在高温下也能和硫、氮气、碳直接化合成Al2S3、AlN、Al4C3(2000℃)。
(2)铝跟水反应
铝与沸水反应2Al+6H2O 2Al(OH)3↓+3H2↑
2Al(OH)3↓+3H2↑
(3)铝与酸反应
① 与非氧化性强酸(稀硫酸、盐酸)反应
2Al+3H2SO4=Al2(SO4)3+3H2↑
2Al+6H+ =2Al3++3H2↑
② 常温下,铝、铁遇浓硫酸、浓硝酸发生钝化。
③ 加热时,铝与热浓硫酸、浓硝酸反应:
2Al+6H2SO4(浓) Al2(SO4)3+3SO2↑+6H2O
Al2(SO4)3+3SO2↑+6H2O
④铝与稀硝酸反应不产生H2
(4)铝与强碱溶液反应
2Al+6H2O=Al(OH)3↓+3H2↑,Al(OH)3+NaOH=Na[Al(OH)4]。上述两个反应叠加得:2Al+2NaOH+6H2O = 2 Na[Al(OH)4]+3H2↑
(5)铝与某些金属氧化物反应
2Al+Fe2O3 Al2O3+2Fe这个反应称为铝热反应、铝粉和氧化铁粉末的混合物称为铝热剂,铝热反应可用于焊接钢轨,可用于冶炼Ni、Mn、V等难熔金属。如10Al+3V2O5
Al2O3+2Fe这个反应称为铝热反应、铝粉和氧化铁粉末的混合物称为铝热剂,铝热反应可用于焊接钢轨,可用于冶炼Ni、Mn、V等难熔金属。如10Al+3V2O5 5Al2O3+6V ,8Al+3Co3O4
5Al2O3+6V ,8Al+3Co3O4 4Al2O3+9Co,8Al+3Fe3O4
4Al2O3+9Co,8Al+3Fe3O4 4Al2O3+9Fe等。
4Al2O3+9Fe等。
6.镁的化合物
(1) 氧化镁
白色粉末,高熔点(2800℃),碱性氧化物,能与水缓慢作用,与酸反应。
MgO+2HCl=MgCl2+H2O
MgO+H2O Mg(OH)2
Mg(OH)2
(2) 氢氧化镁
白色粉末,难溶于水,与H+作用,与NH4Cl溶液作用,对热不稳定。
Mg(OH)2+2HCl=MgCl2+2H2O
Mg(OH)2 MgO+H2O↑
MgO+H2O↑
5.海水提镁:海水提镁,最基本的方法是往海水里加碱,得到氢氧化镁沉淀,将沉淀分离出来后再加入盐酸把它变成氯化镁;之后经过滤、干燥、电解,就可得到镁。反应原理是
Mg2++2OH-==Mg(OH)2↓, Mg(OH)2+2HCl=MgCl2+2H2O , MgCl2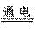 Mg+Cl2↑
Mg+Cl2↑
或把从海水提取出食盐、KCl、Br2以后留下的母液浓缩,就得到卤块,主要成分是MgCl2·6H2O,然后脱水 MgCl2·6H2O MgCl2+6H2O,最后电解熔融的氯化镁得到镁。
MgCl2+6H2O,最后电解熔融的氯化镁得到镁。
4.镁盐与氨水反应产生Mg(OH)2沉淀,Mg(OH)2又能溶解在NH4Cl溶液中。
前者是由Mg(OH)2的特殊溶解性决定。在常见的难溶性氢氧化物中,Mg(OH)2的溶解度最大。故产生Mg(OH)2的条件是:浓的Mg2+ 盐溶液与浓氨水反应。
后者是由Mg(OH)2的电离性质和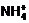 的水解性质决定。通常简单认为Mg(OH)2完全电离,故能溶解在饱和NH4Cl溶液中。
的水解性质决定。通常简单认为Mg(OH)2完全电离,故能溶解在饱和NH4Cl溶液中。
MgCl2+2NH3·H2O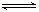 Mg(OH)2+2NH4Cl
Mg(OH)2+2NH4Cl
3.镁与水解显酸性的盐溶液的反应
Mg+2NH4Cl =MgCl2+2NH3+H2↑
2.镁跟酸的反应
与稀盐酸、稀硫酸等非氧化性酸发生置换反应。
Mg+2HCl=MgCl2+H2↑
镁是一种轻金属,它的密度只有铝的密度的2/3;另外,镁合金的强度高、机械性能好。这些特性使镁成为制造汽车、飞机、火箭的重要材料,从而获得“国防金属”的美誉。在冶金工业上,镁常用作还原剂和脱氧剂。
1.镁跟非金属或氧化物反应
(1) 常温下氧化生成氧化物保护层,具有抗腐蚀的性质。
(2) 镁可以在O2、N2、CO2等气体中燃烧。
2Mg+O2 2MgO
2MgO
CO2+2Mg 2MgO+C
2MgO+C
3Mg+N2 Mg3N2
Mg3N2
(3) 镁也能跟SiO2反应:2Mg+SiO2=2MgO+Si
(4) 镁与冷水反应很慢,在加热时反应加快。
Mg+2H2O=Mg(OH)2+H2↑
6.一般活泼金属能从盐中置换出不活泼金属,但对IA非常活泼的金属Na、K等除外。如:2Na+CuS04+2H20=Cu(OH)2↓+H2↑+Na2S04
5.试剂瓶中的药品取出后,一般不能放回原瓶,但IA金属Na、K等除外。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com