
1.单质铁的性质:
(1)物理性质
银白色光泽、密度大,熔沸点高,延展性、导电、导热性较好、能被磁铁吸引。
(2)化学性质
铁是较活泼的金属,铁原子的最外层电子数为2个,可失去2个或3个电子而显+2价或+3价,但+3价的化合物较稳定。
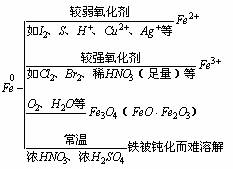
①与非金属反应:
3Fe + 2O2 Fe3O4
Fe3O4
2Fe + 3C12 2FeCl3
2FeCl3
说明 铁丝在氯气中燃烧时,生成棕黄色的烟,加水振荡后,溶液显黄色.
Fe + S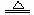 FeS
FeS
说明 铁跟氯气、硫反应时,分别生成+2价和+3价的铁,说明氧化性:氯气>硫.
②与水反应:
a.在常温下,在水和空气中的O2、CO2等的共同作用下,Fe易被腐蚀(铁生锈).
b.在高温下,铁能与水蒸气反应生成H2:3Fe + 4H2O(g)  Fe3O4 + 4H2
Fe3O4 + 4H2
③与酸反应:
a.与非氧化性酸(如稀盐酸、稀H2SO4等)的反应.例如: Fe + 2H+ = Fe2+ + H2↑
b.铁遇到冷的浓H2SO4、浓HNO3时,产生钝化现象,因此金属铁难溶于冷的浓H2SO4或浓HNO3中.
④与比铁的活动性弱的金属的盐溶液发生置换反应.例如: Fe + Cu2+ = Fe2+ + Cu
归纳:铁的化学性质及在反应后的生成物中显+2价或+3价的规律如下;
铁位于第四周期第Ⅷ族,原子结构示意图为:
电子排布式为:1s22s22p63s23p63d64s2
铁是地壳中最丰富的元素之一,含量为4.75%,在金属中仅次于铝。铁分布很广,能稳定地与其他元素结合,常以氧化物的形式存在,有赤铁矿(主要成分是Fe2O3)、磁铁矿(主要成分是Fe3O4)、褐铁矿(主要成分是Fe2O3·3H2O)、菱铁矿(主要成分是FeCO3)、黄铁矿(主要成分是FeS2)、钛铁矿(主要成分是FeTiO3)等。土壤中也含铁1%-6%。铁是活泼的过渡元素。
2.硬水的软化方法
①加热法 通过加热煮沸使暂时硬水所含钙、镁的酸式碳酸盐发生分解,生成难溶的碳酸钙、碳酸镁的方法。反应原理:Ca(HCO3)2 CaCO3↓+H2O+CO2↑ Mg(HCO3)2
CaCO3↓+H2O+CO2↑ Mg(HCO3)2 MgCO3↓+H2O+CO2↑
生成的碳酸镁在加热条件下可与水进一步反应生成更难溶的氢氧化镁。反应为MgCO3 + H2O
MgCO3↓+H2O+CO2↑
生成的碳酸镁在加热条件下可与水进一步反应生成更难溶的氢氧化镁。反应为MgCO3 + H2O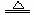 Mg(OH)2↓+CO2↑,这种方法只适用于除去暂时硬度。
Mg(OH)2↓+CO2↑,这种方法只适用于除去暂时硬度。
②药剂法 即向水中加入适当的化学药剂,促使溶解在水中的Ca2+、Mg2+以沉淀的形式从水中分离出来达到软化的方法。常用的药剂法有石灰--纯碱法等。
反应原理为:Ca(HCO3)2+Ca(OH)2=2CaCO3↓+2H2O Mg(HCO3)2+2Ca(OH)2=Mg(OH)2↓+2CaCO3↓+2H2O
MgCl2+ Ca(OH)2= Mg(OH)2↓+CaCl2(将由镁离子引起的硬度转化为由钙离子形成的硬度)
CaCl2 +Na2CO3= CaCO3↓+2NaCl
③离子交换法 采用离子交换剂软化水的一种方法。离子交换剂分阳离子交换剂和阴离子交换剂两类。它们能与水溶液交换具有同性电荷的离子,从而除去或减少不需要的离子。这种方法可同时除去暂时硬度和永久硬度,工业锅炉用水的软化常用磺化煤等阳离子交换剂(NaR),发生如下离子交换作用:2NaR+Ca2+=CaR2+2Na+ 2NaR+Mg2+=MgR2+2Na+
1.基本概念
①硬水和软水:
硬水:含有较多的Ca2+和Mg2+的水。
软水:不含或只含少量Ca2+和Mg2+的水。
②暂时硬度和永久硬度
暂时硬度:由碳酸氢钙或碳酸氢镁所引起的水的硬度。
永久硬度:由钙和镁的硫酸盐或氯化物等引起的水的硬度。
③暂时硬水和永久硬水
暂时硬水:含有暂时硬度的水。
永久硬水:含有永久硬度的水。
氢氧化铝沉淀量图象大致可以分为如图六类。[图中纵坐标均为Al(OH)3沉淀量,横坐标
为加入试剂的体积]
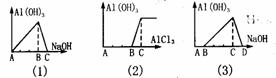
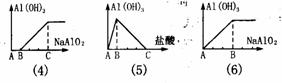
(1)图为向AlCl3溶液中滴人NaOH溶液
反应:A-B段:Al3++3OH- = Al(OH)3↓ , B-C段:Al(OH)3+OH- =[Al(OH)4]-
(2)图为向NaOH溶液中滴入AlCl3溶液
反应A-B段Al3+ +4OH- = [Al(OH)4]- B-C段3[Al(OH)4]- +Al3+ =4Al(OH)3↓
(3)图为向盐酸酸化了的AlCl3溶液中滴入NaOH溶液
A-B段: OH- +H+ = H2O B-C段:Al3++3OH- = Al(OH)3↓
C-D段:Al(OH)3+OH- =[Al(OH)4]-
(4)图为向盐酸中加入N[Al(OH)4]溶液
A-B段:[Al(OH)4]-+4H+= Al3+ +4H2O B-C段:3[Al(OH)4]-+Al3+=4Al(OH)3↓
(5)图为向Na[Al(OH)4]溶液中加入盐酸
A-B段:[Al(OH)4]- +H+ = Al(OH)3↓+H2O B-C段: Al(OH)3+3H+ = Al3+ +3H2O
(6)图为向AlCl3溶液中滴入Na[Al(OH)4]溶液
A-B段:3[Al(OH)4] -+Al3+ =4Al(OH)3↓
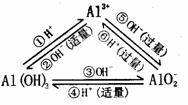
 应用
应用
①制取Al(OH)3:A13++3NH3·H2O=Al(OH)3↓+3NH4+ 3[Al(OH)4]-+Al3+ =4Al(OH)3↓ [Al(OH)4]-+CO2 = Al(OH)3↓+HCO3-
②离子共存问题:Al3+与OH-、S2-、HS-、[Al(OH)4]-、CO32-、HCO3-因双水解反应或生成沉淀而不能大量共存;[Al(OH)4]-与H+、NH4+、Al3+、Fe3+等不能大量共存。
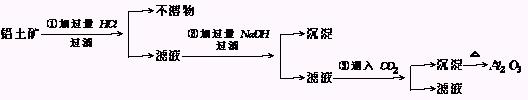
6.铝土矿
工业上用铝土矿(主要成分是Al2O3·H2O、Al2O3·3H2O以及少量Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料,提取的操作过程可用以下流程图表示
5.明矾
明矾是含有结晶水的硫酸钾和硫酸铝的复盐。化学式KAl(SO4)2·12H2O
KAl(SO4)2·12H2O=K++Al3++2SO42-+12H2O,Al3+容易水解,生成胶状的氢氧化铝Al(OH)3
Al3++3H2O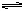 Al(OH)3(胶体)+3H+,氢氧化铝胶体的吸附能力很强,可以吸附水里悬浮的杂质,并形成沉淀,使水澄清。所以,明矾是一种较好的净水剂。
Al(OH)3(胶体)+3H+,氢氧化铝胶体的吸附能力很强,可以吸附水里悬浮的杂质,并形成沉淀,使水澄清。所以,明矾是一种较好的净水剂。
4.硫酸铝
(1)硫酸铝溶液呈酸性,硫酸铝的水解 Al3++3H2O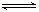 Al(OH)3+3H+
Al(OH)3+3H+
(2)硫酸铝溶液与碳酸钠溶液混合,2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
(3)泡沫灭火器,一般呈有1mol/LAl2(SO4)3和1mol/L NaHCO3 溶液,反应原理为
Al3++3HCO3-=Al(OH)3↓+3CO2↑
3.氢氧化铝
(1)氢氧化铝是几乎不溶于水的白色胶状物质,能凝聚水中的悬浮物,又能吸附色素,因此可用于水的净化。
(2)氢氧化铝是两性氢氧化物(既能与酸反应生成盐和水,又能和碱反应时生成盐和水的氢氧化物),氢氧化铝具有两性,可用电离平衡移动的原理来解释:氢氧化铝的电离方程式可表示如下:
Al(OH)3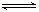 Al3++3OH-
Al(OH)3+H2O
Al3++3OH-
Al(OH)3+H2O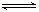 [Al(OH)4]-+H+
[Al(OH)4]-+H+
(碱式电离) (酸式电离)
其电离程度相当微弱,只有加入强酸(或强碱)时,大量的H+(或OH-)才能破坏氢氧化铝的电离平衡,使平衡向右(或左)移动,生成铝盐(或四羟基合铝酸盐),所以氢氧化铝既能与酸反应,又能与碱反应.当加入弱酸或弱碱时,因H+或OH-浓度太小,不能使上述平衡移动,因此Al(OH)3只溶于强酸或强碱,而不溶于弱酸或弱碱。反应为Al(OH)3+3H+=Al3++3H2O ,Al(OH)3+OH-=[Al(OH)4]-
(3)氢氧化铝受热分解2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
(4)Al(OH)3的制备:
①用弱碱氨水与可溶性铝盐反应.Al3++3NH3·H2O Al(OH)3↓+3NH4+
Al(OH)3↓+3NH4+
②用可溶性四羟基合铝酸盐与CO2反应
[Al(OH)4]-+CO2 Al(OH)3↓+HCO3-(CO2过量)
Al(OH)3↓+HCO3-(CO2过量)
2[Al(OH)4]-+CO2 2Al(OH)3↓+CO32-+H2O(CO2少量)
2Al(OH)3↓+CO32-+H2O(CO2少量)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com