
4.金属性强弱判断的常用方法
(1)利用原子结构和元素在周期表中的位置判断。
在周期表中,同一周期从左到右,元素的金属性逐渐减弱。失电子能力逐渐减弱。同一主族元素从上到下元素的金属性逐渐增强。
(2)从元素单质跟水或酸起反应置换出氢气的难易判断。
与水反应越易、越剧烈的金属单质,其原子越易失电子,该金属活泼性越强。如Na、Mg、Al,Na与冷水反应剧烈放出H2,Mg与热水反应较快,Al与热水反应较缓慢,所以金属性由强到弱的顺序为Na>Mg>Al。又如Na、Fe、Cu分别加入盐酸中,Na反应很剧烈,Fe较顺利,Cu不反应,则金属性由强到弱的顺序为Na>Fe>Cu。
(3)根据元素最高价氧化物对应的水化物(氧化物间接或直接跟水生成的化合物)即氢氧化物的碱性的强弱来判断金属性的强弱。
如NaOH为强碱、Mg(OH)2为弱碱、Al(OH)3为两性,判断出金属性由强到弱的顺序Na>Mg>Al。
(4)根据组成原电池的电极情况来判断:
通常当两种不同的金属构成原电池的两极时,做负极(失电子被氧化的极)的金属性较强。如比较锌和铜金属性强弱时,把锌片和铜片用导线连接后浸入稀H2SO4中,组成原电池,发现锌片溶解,铜片上有氢气析出,说明锌为负极,所以锌比铜金属活泼性强。
(5)根据物质间置换反应来判断:
通常强还原剂和强氧化剂反应生成弱氧化剂和弱还原剂。如比较铁和铜的金属性强弱时,可将铁片放入硫酸铜溶液中,在铁片表面能置换出单质铜:Fe+Cu2+=Cu+Fe2+。说明铁比铜的金属性强。
(6)根据电解时溶液中离子放电顺序来判断:通常电解相同物质的量浓度的金属离子的溶液时,金属离子在阴极先放电析出的金属单质,其金属性较弱,后放电的离子,原来的金属单质的金属性较强。如把等浓度的AgNO3、Cu(NO3)2混合溶液进行电解时,能观察到在阴极表面先析出银,所以铜的金属性比银的强。
例1 A、B、C是三种短周期元素的单质,甲、乙是两种常见的化合物。这些化合物和单质之间存在如下图所示的关系。
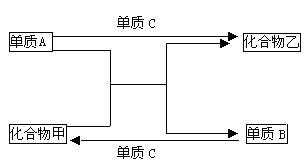
据此判断:
(1)在甲、乙两种化合物中,不含有组成A元素的化合物是_________,不含组成B元素的化合物是_______________(用“甲”、“乙”填写)。
(2)单质A是_____________(填“金属”、“非金属”或“既可以是金属又可以是非金属”)。
(3)若单质A是___________,则单质B、C分别是______________;若单质A是________,则单B、C分别是_____________;若单质A是___________,则单质B、C分别是________________。
解析 (1)从图中可发现下列反应关系:“单质B+单质C→化合物甲”,故甲中不含A元素;“单质A+单质C→化合物乙”,故乙中不含有B元素。
(2)从图示信息进行转换,可提炼出“单质A+ 化合物甲→单质B+化合物乙”该反应属置换反应。置换反应有如下几种情况:
第一种情况:金属单质置换出金属单质。结合铝热反应可获得下列各种可能:(a)A为铝、B为铁、C为氧气等(铝与金属氧化物如四氧化三铁、三氧化二铁、氧化铜、二氧化锰、五氧化二钒等多种氧化物进行的反应,因而可得出多组答案。但由于题中限定了是短周期元素,可排除这些可能性)。
第二种情况:非金属单质置换出非金属单质。结合一些反应实例可获得答案(b)A、B、C依次为(下同)Cl2、S、H2;(c)O2、S、H2;(d)F2、O2、H2。(还可进一步分析:反应中单质表现了何种性质?总结出:氧化性A>B。)这样,就可进而获得更多答案(e)Cl2、Br2、H2;(f)Cl2、I2、H2;(g)Br2、I2、H2;(h)I2、S、H2;(I)C、H2、O2(制水煤气);(j)C、Si、O2(工业上制硅);(k)Br2、S、H2;(l)Cl2、N2、H2;(m)Si、H2、F2。
第三种情况:金属单质置换出非金属单质。(n)4)Mg、C、O2。
第四种情况:非金属单质置换出金属单质。(o)H2、Cu、O2;(p)H2、Fe、O2;(q)C、Cu、O2(由于铁、铜等不是短周期元素,所以不合题意)。
答案为:(1)甲;乙。
(2)单质A可以是金属也可以是非金属。
(3)可以有多组答案(见思路精析)。
例2 下图每一方框表示有关反应的某一反应物或生成物,有关操作已略去。又知A为高熔点物质,B为无色气体,D为一种天然出产的矿石的主要成分,可作为颜料。G在开始刚生成时呈白色。
试回答:
(1)写出化学式:A ,D ,G 。

(2)写出化学方程式:C+D的反应 。
(3)写出离子方程式:
①A J:
。
J:
。
②I+J K:
。
K:
。
答案:(1)A为Al2O3,D 为Fe2O3, G为Fe(OH)2
(2)①2Al+Fe2O3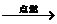 2Fe+Al2O3
2Fe+Al2O3
(3)①Al2O3+2OH-+3H2O
 2(Al (OH)4)-
2(Al (OH)4)-
②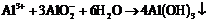
3.金属氧化物对应的水化物为碱,碱的稳定性比较:
①K、Ca、Na氧化物和水反应,生成可溶性的碱KOH和NaOH及微溶性碱Ca(OH)2:
K2O+H2O=2KOH,Na2O+H2O=2NaOH,CaO+H2O=Ca(OH)2;这些氢氧化物受热不易分解。
②Mg、Al氧化物和水缓慢反应,生成难溶性碱Mg(OH)2和难溶性两性氢氧化物Al(OH)3、Mg(OH)2、Al(OH)3受热易分解,如:2Al(OH)3  Al2O3+3H2O
Al2O3+3H2O
③Al以后的金属氧化物,不溶于水,也不与水反应,其对应的水化物(碱)不能由氧化物与水直接反应生成,而碱的热稳定性逐渐减弱,即受热易分解。如:
2Fe(OH)3
 Fe2O3+3H2O
Fe2O3+3H2O
Cu(OH)2  CuO+H2O
CuO+H2O
2.金属化学性质
在水溶液中,按金属失电子形成水合阳离子能力的大小,而排列出金属活动性顺序表:

(1)金属与水反应:
①活泼金属K、Ca、Na与冷水发生剧烈置换反应,生成碱和氢气。如:2K+2H2O=2KOH+H2↑
②较活泼金属Mg、Al与沸水发生置换反应,生成碱和氢气。如:Mg+2H2O=Mg(OH)2↓+H2↑
③金属Zn、Fe、Sn、Pb在高温下与水蒸汽发生置换反应,生成金属氧化物和氢气。如:
3Fe+4H2O(气)  Fe3O4+4H2↑
Fe3O4+4H2↑
④氢后金属不与水发生反应
(2)金属与氧气反应:
①活泼金属K、Ca、Na常温下在空气中易被氧化,在空气中又可发生燃烧。如:
4Na+O2=2Na2O,继续反应:2Na2O+O2=2Na2O2或2Na+O2 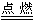 Na2O2
Na2O2
②较活泼金属Mg、Al常温下在空气中易氧化,形成氧化膜,也可发生燃烧。如:
4Al+3O2=2Al2O3 4Al+3O2(纯)  2Al2O3
2Al2O3
③金属Zn、Fe、Sn、Pb常温在干燥空气中不发生氧化反应,加热能被氧化,纯氧中可发生燃烧。如:
3Fe+2O2(纯)  Fe3O4
Fe3O4
④金属Cu、Hg在强热条件下,只氧化而不发生燃烧。如:
2Cu+O2
 2CuO
2CuO
⑤Hg以后金属不能被氧气氧化
(3)金属与非氧化性酸(盐酸 稀H2SO4)反应
①氢前金属能置换酸中的氢,生成盐和氢气。②氢后金属不能发生反应
(4)金属与氧化性酸(浓H2SO4,浓稀HNO3)反应,
①活泼金属K、Ca、Na和氧化性酸反应较复杂(不要求掌握);
②Mg→Ag与氧化性酸发生氧化一还原反应,生成盐、水和气体,但气体不是氢气,而是含氧酸的还原产物,其中硫酸还原产物是SO2↑,浓硝酸还原产物是NO2↑,稀硝酸还原产物是NO↑。如:
Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
③Pt、Au只能溶于王水。
④常温下,浓H2SO4、浓HNO3使Fe、Al表面生成致密氧化膜,而不生成H2,即表面发生“钝化”。
(5)金属与盐溶液反应:
①活泼金属K、Ca、Na放入盐溶液后,首先与水发生置换反应,生成碱和氢气;所生成的碱再与盐发生复分解反应。如Na投入CuSO4溶液中2Na+2H2O=2NaOH+H2↑、2NaOH+CuSO4=Cu(OH)2↓+Na2SO4或合并成:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑
一般是活泼金属和不活泼金属的盐溶液反应,生成不溶性碱、氢气和盐。
②Mg和Mg以后的金属,一般发生“活泼”金属单质(前面金属)将后面的金属从盐溶液中置换出来;如:
Fe+CuSO4=FeSO4+Cu.有例外,发生氧化还原反应,如,Cu+2FeCl3=2FeCl2+CuCl2,Fe+2FeCl3=3FeCl2。
(6)某些金属与强碱溶液反应:Zn、Al和强碱溶液发生反应,生成盐和氢气。
2Al+2NaOH+6H2O=2Na(Al (OH)4)+3H2↑ Zn+2NaOH=Na2ZnO2+H2↑
(7)某些金属与氧化物反应:
①Mg与CO2发生置换反应,生成黑、白色两种粉末。2Mg+CO2  2MgO+C
2MgO+C
②Al和其它金属氧化物,发生铝热反应放出大量热,如:8Al+3Fe3O4  4Al2O3+9Fe
4Al2O3+9Fe
(8)金属与非金属(S、F2、Cl2等)反应
①金属性越强,越易发生化合,如:2Na+S=Na2S,Fe+S  FeS,2Cu+S
FeS,2Cu+S  Cu2S。
Cu2S。
②Au、Pt难与非金属直接发生反应。
③ⅡA金属Mg等和ⅠA金属Li与氮气发生化合反应,如:3Mg+N2  Mg3N2.
Mg3N2.
常见金属的主要化学性质总结列于下表:
|
金属活动性 顺序 |
 K Ca Na Mg Al Mn Zn Fe Sn Pb (H) Cu Hg Ag Pt Au K Ca Na Mg Al Mn Zn Fe Sn Pb (H) Cu Hg Ag Pt Au |
||||
|
金属原子 失电子能力 |
依次减小,还原性减弱 |
||||
|
空气中跟氧气的反应 |
易被氧化 |
常温时能被氧化 |
|
加热时能被氧化 |
不能被氧化 |
|
跟水的反应 |
常温可置换出水中的氢 |
加热或与水蒸气反应时能置换出水中的氢 |
|
不与水反应 |
|
|
跟酸的反应 |
能置换出稀酸(如HCl、H2SO4)中的氢 |
|
不能置换出稀酸中的氢 |
||
|
反应剧烈 |
反应程度依次减弱 |
|
能跟浓硫酸、硝酸反应 |
能跟王水反应 |
|
|
跟盐的反应 |
位于金属活动性顺序前面的金属可以将后面的金属从其盐溶液中置换出来 |
||||
|
跟碱的反应 |
Al、Zn等具有两性的金属可以与碱反应 |
1.金属物理性质
(1)状态:在常温下,除汞(Hg)外,其余金属都是固体.
(2)颜色:大多数金属呈银白色,而金、铜、铋具有特殊颜色.金属都是不透明的,整块金属具有金属光泽,但当金属处于粉末状时,常显不同颜色.
(3)密度:金属的密度相差很大,常见金属如钾,钠、钙、镁、铝均为轻金属(密度小于4.5 g·cm-3),密度最大的金属是锇,高达21.45 g·cm-3.
(4)硬度:金属的硬度差别很大,如钠、钾的硬度很小,可用小刀切割;最硬的金属是铬.
(5)熔点:金属的熔点差别很大,如熔点最高的金属为钨,其熔点为3410℃,而熔点最低的金属为汞,其熔点为-38.9℃,比冰的熔点还低.
(6)大多数金属都具有延展性,可以被抽成丝或压成薄片.其中延展性最好的是金.
⑺金属都是电和热的良导体.其中银和铜的传热、导电性能最好.
3.按自然界中的含量
常见金属:如铁(4.75%) 铝(7.7%) 钙(3.45%)等
稀有金属:如锆、铌、钼等
2.按密度
轻金属:密度﹤4.5g/cm3(如钠、镁、铝)
重金属:密度﹥4.5g/cm3(如铁、铜、W)
1.冶金工业
黑色金属:Fe、Cr、Mn(黑色金属的颜色不一定是黑色,如纯净的铁、铬的颜色是银白色)
有色金属:除Fe、Cr、Mn以外的所有金属
2.金属元素原子结构特征和晶体结构
(1)原子最外层电子:一般≤4个。(有例外)
(2)价电子:主族--最外层电子;副族--最外层+次外层电子。如铁原子最外层上只有两个电子,可铁的化合价有+2价和+3价;锰原子的最外层也只有两个电子,但锰的化合价有+2价(MnCl2)、+4价(MnO2)、+6价(K2MnO4)+7价(KMnO4)等。
(3)半径:同一周期原子 r金属>r非金属(不包括稀有气体元素);同一元素的原子和阳离子 r原子>r阳离子,如Na半径>Na+半径。
(4)金属阳离子的电子层结构通常与上一周期元素的稀有气体元素原子的电子层结构相同,如Na+、Mg2+与Ne;与上一周期元素的阴离子的电子层结构相同,如Na+、Mg2+与O2-、F-。
(5)晶体结构:晶体中金属阳离子与自由电子之间形成金属键,通过金属键原子结合成晶体,即为金属晶体。
1.金属元素在周期表中的位置及存在

(1)金属元素位于周期表B-At连线左下方。
(2)金属元素包括:主族元素中除H外的ⅠA、ⅡA全部、ⅢA的Al、Ga、In、Tl、ⅣA的Ge、Sn、Pb、ⅤA的Sb、Bi及ⅥA的Po和全部过渡元素(包括副族元素和Ⅷ族元素)。
(3)地壳中丰度最高的10种元素中,按丰度顺序为氧、硅、铝、铁、钙、钠、钾、镁、氢、钛,这其中金属元素种类居多。
(4)活泼的金属元素以其稳定的化合物存在于自然界,而少数化学性质不活泼金属元素如Au、Pt、Ag等在自然界以游离态形式存在。
5.铜的主要用途
铜在电气和电子工业中主要用于制造电线、通讯电缆等。这方面应用占铜的工业总用量的一半左右,半导体器件中的硅芯片上用铜代替铝线;建筑业上用铜制造水管及其它排水设施,具有独特的杀菌功能,抑制细菌生长。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com