
4、氯气的制法
(1)实验室制法 ∆
药品及原理:MnO2 + 4HCl(浓) === MnCl2 + 2H2O + Cl2↑
强调:MnO2跟浓盐酸在共热的条件下才反应生成Cl2,稀盐酸不与MnO2反应。
仪器装置:发生装置---收集装置---吸收装置
实验步骤:检密-装药-固定-加热-收集
收集方法:向上排空气法 (或排饱和食盐水法)
净化装置:用饱和食盐水除去HCl,用浓硫酸干燥
尾气处理:用碱液吸收
(2)氯气的工业制法:(氯碱工业)
通 电
2NaCl + 2H2O ==== 2NaOH + H2↑ + Cl2↑
3、氯水的成分及性质
氯气溶于水得黄绿色的溶液----氯水。在氯水中有少部分氯分子与水反应,Cl2 + H2O = HCl + HClO (次氯酸),大部分是以Cl2分子状态存在于水中。
注意:(1)在新制的氯水中存在的微粒有:H2O、Cl2、HClO、H+、Cl-、ClO-、OH-;久置氯水则几乎是盐酸溶液
 ① 一元弱酸,比H2CO3弱
① 一元弱酸,比H2CO3弱
光
(2)HClO的基本性质 ② 不稳定,2HClO === 2HCl + O2↑
③ 强氧化性;
④ 漂白、杀菌能力,使色布、品红溶液等褪色,
故氯水可用作自来水消毒。
(3)几种漂白剂的比较
|
漂白剂 |
HClO |
Na2O2(H2O2) |
SO2 |
活性炭 |
|
漂白原理 |
氧化漂白 |
氧化漂白 |
化合漂白 |
吸附漂白 |
|
品红溶液 |
褪色 |
褪色 |
褪色 |
褪色 |
|
紫色石蕊 |
先变红后褪色 |
褪色 |
只变红不褪色 |
褪色 |
|
稳定性 |
稳定 |
稳定 |
不稳定 |
-- |
例1、 (1)液氯和氯水是一种物质吗? 答案:不是。液氯是Cl2在加压或冷却时变成的液态Cl2,是纯净物,而氯水是氯气溶于水中形成的溶液,是混合物。 (2)①怎样证明新制氯水中含有大量Cl2? ②用实验证明氯气能与水反应。 答案:①观察氯水颜色,呈黄绿色,此即氯气的颜色,说明新制氯水中含大量Cl2。 ②向新制的氯水中加AgNO3溶液.若产生白色沉淀,说明氯水中含有Cl-,即有部分氯气与水反应了。 Cl2+H2O=HCl+HClO ,AgNO3+HCl=AgCl↓+HNO3 另法:也可向新制氯水中放入一红布条或滴入几滴品红溶液,若布条或品红褪色,说明新制氯水中有HClO,即Cl2与水发生了反应。 (3)氯水中有多种化学物质,故性质较复杂。下列现象各是基于哪种物质的什么性质? ①氯水能使紫色石蕊试液先变红后褪色。 ②向氯水中滴加饱和NaHCO3溶液,有气泡出现。 ③向氯水中滴入AgNO3溶液,产生白色沉淀。 答案:①H+、HClO ②H+ ③Cl-
2、化学性质:氯气的化学性质很活泼的非金属单质。
(1)与金属反应(与变价金属反应,均是金属氧化成高价态)
如:①2Na+Cl2 2NaCl(产生白烟)
2NaCl(产生白烟)
②Cu+Cl2 CuCl2(产生棕黄色的烟)
CuCl2(产生棕黄色的烟)
③2Fe+3Cl2 2FeCl3(产生棕色的烟)
2FeCl3(产生棕色的烟)
注:常温下干燥的氯气或液氯不与铁反应,所以液氯通常储存在钢瓶中。
(2)与非金属反应
如:①H2+Cl2 2HCl(发出苍白色火焰,有白雾生成)--可用于工业制盐酸
2HCl(发出苍白色火焰,有白雾生成)--可用于工业制盐酸
H2+Cl2 2HCl(会发生爆炸)--不可用于工业制盐酸
2HCl(会发生爆炸)--不可用于工业制盐酸
②2P+3Cl2 2PCl3(氯气不足;产生白雾)
2PCl3(氯气不足;产生白雾)
2P+5Cl2 2PCl5(氯气充足;产生白烟)
2PCl5(氯气充足;产生白烟)
(3)与水反应:Cl2+H2O = HCl+HClO
(4)与碱反应
Cl2+2NaOH = NaCl+NaClO+H2O(用于除去多余的氯气)
2Cl2+2Ca(OH)2 = Ca(ClO)2+CaCl2+2H2O(用于制漂粉精)
Ca(ClO)2+CO2+H2O = CaCO3↓+2HClO(漂粉精的漂白原理)
(5)与某些还原性物质反应
如:①2FeCl2+Cl2 = 2FeCl3
②2KI+Cl2 = 2KCl + I2(使湿润的淀粉-KI试纸变蓝色,用于氯气的检验)
③SO2+Cl2+2H2O = 2HCl + H2SO4
(6)与某些有机物反应
如:①CH4+Cl2  CH3Cl + HCl(取代反应)
CH3Cl + HCl(取代反应)
②CH2=CH2+Cl2 → CH2ClCH2Cl(加成反应)
1、物理性质:常温下,氯气是黄绿色、有刺激性、能溶于水、比空气重、易液化的有毒气体。
生活生产中使用最广泛的是铁 地壳中含量最多的金属是铝
最活泼的金属元素是铯,最硬的金属是铬
熔点最高的金属是钨,熔点最低的金属是汞,密度最大的金属是锇
延性最好的金属是铂,展性最好的金属是金
杀菌最好的金属是银,每升水中只要有一千亿分之二克的Ag+就可灭菌
 例3、A、B、C、D、E五种物质都含有同一种短周期元素,它们按下图所示关系相互转化,已知A为单质,则
例3、A、B、C、D、E五种物质都含有同一种短周期元素,它们按下图所示关系相互转化,已知A为单质,则
(1)写出A-E的分子式;
(2)写出A D、C
D、C D、C
D、C E反应的化学方程式。
E反应的化学方程式。
分析:本题属于图示转化关系进行物质推断的测试题。物质推断题的解法甚多。因题而异。本题宜用图示顺推--利用题述第一层转化(A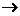 B、A
B、A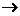 C)为突破口。因为单质与氧气的反应因条件不同(点燃与放置)而产物有异的短周期元素只有钠,由此推出B为Na2O,C为Na2O2;然后顺藤摸瓜,根据A、B、C在一定条件下都能转化为D,推出D为NaOH,而转化反应中的另一反应物为H2O;最后根据B、C、D在一定条件下都能转化为E推出E为 Na2CO3,其转化反应的另一反应物为CO2。
C)为突破口。因为单质与氧气的反应因条件不同(点燃与放置)而产物有异的短周期元素只有钠,由此推出B为Na2O,C为Na2O2;然后顺藤摸瓜,根据A、B、C在一定条件下都能转化为D,推出D为NaOH,而转化反应中的另一反应物为H2O;最后根据B、C、D在一定条件下都能转化为E推出E为 Na2CO3,其转化反应的另一反应物为CO2。
解答:
(1)A为Na、B为Na2O、C为Na2O2、D为NaOH、E为Na2CO3
(2)A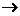 D:2Na+2H2O == 2NaOH + H2
D:2Na+2H2O == 2NaOH + H2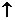
C D:2Na2O2+2H2O == 4NaOH+O2
D:2Na2O2+2H2O == 4NaOH+O2
C E: 2Na2O2+2CO2 == 2Na2CO3+O2
E: 2Na2O2+2CO2 == 2Na2CO3+O2
评述:本题以物质推断题的形式考查钠及其重要化合物相互转化反应的知识,也考查了将实际问题分解,找出应答关键的思维能力。然而熟悉它们之间的相互转化并落实到反应的化学方程式是作出迅速而准确判断的前提。因此将所学知识融会贯通,能横向、纵向串联,使之网络化以进行有序记忆十分重要。
3.钛合金:金属钛是一种新型的结构材料。钛的密度为4.54g·cm-3,比钢轻,可是,钛的机械性能与钢相似。钛恰好兼有钢和铝的优点。液体钛几乎能溶解所有的金属,因此可以和多种金属形成合金。将钛加入钢中制得的钛钢坚韧而富有弹性。钛的表面容易形成致密的、钝性的氧化物保护膜,使得钛具有优良的抗腐蚀性,特别是对海水的抗腐蚀性很强。由于金属钛具有优良的性能,在国防和高能技术中,钛占有重点地位,在航海和航空制造业中得到广泛的应用。
2.合金特性:合金比它的成分金属具有良好的物理和化学等多方面性能。如合金的熔点一般比它的成分金属熔点低,合金适宜铸造;又如硬铝合金的强度和硬度都比纯铝大,几乎相当钢材,且密度小。
1.合金概念:两种或两种以上金属(或金属与非金属)熔化而成的具有金属特性的物质叫合金(合金为混合物)。如:钢铁为铁碳合金。
2.金属的回收 地球上的金属矿产资源是有限的,而且是不能再生的.随着人们的不断开发利用,矿产资源将会日渐减少.金属制品在使用过程中会被腐蚀或损坏,同时由于生产的发展,新的产品要不断替代旧的产品,因而每年就有大量废旧金属产生.废
旧金属是一种固体废弃物,会污染环境.要解决以上两个问题,最好的方法是把废旧金属作为一种资源,加以回收利用.这样做,既减少了垃圾量,防止污染环境,又缓解了资源短缺的矛盾.回收的废旧金属,大部分可以重新制成金属或它们的化合物再用.
1.金属的冶炼
(1)从矿石中提取金属的一般步骤有三步:①矿石的富集.除去杂质,提高矿石中有用成分的含量;②冶炼.利用氧化还原反应原理,在一定条件下,用还原剂将金属矿石中的金属离子还原成金属单质;⑧精炼.采用一定的方法,提炼纯金属.
(2)冶炼金属的实质:用还原的方法,使金属化合物中的金属离子得到电子变成金属原子.
(3)金属冶炼的一般方法:
①加热法.适用于冶炼在金属活动顺序表中,位于氢之后的金属(如Hg、Ag等).例如:
2HgO 2Hg + O2↑
HgS + O2
2Hg + O2↑
HgS + O2 Hg + SO2↑
Hg + SO2↑
2Ag2O 4Ag + O2↑
2AgNO3
4Ag + O2↑
2AgNO3 2Ag + 2NO2↑+ O2↑
2Ag + 2NO2↑+ O2↑
②热还原法.适用于冶炼金属活动顺序表中Zn、Fe、Sn、Pb等中等活泼的金属.常用的还原剂有C、CO、H2、Al等.例如:
Fe2O3
+ 3CO 2Fe + 3CO2(炼铁)
ZnO + C
2Fe + 3CO2(炼铁)
ZnO + C Zn + CO↑(伴生CO2)
Zn + CO↑(伴生CO2)
WO3 + 3H2 W + 3H2O
Cr2O3 + 2Al
W + 3H2O
Cr2O3 + 2Al 2Cr + A12O3(制高熔点的金属)
2Cr + A12O3(制高熔点的金属)
⑧熔融电解法.适用于冶炼活动性强的金属如K、Ca、Na、Mg、A1等活泼的金属,通过电解其熔融盐或氧化物的方法来制得.例如:
2A12O3 4Al + 3O2↑
2NaCl
4Al + 3O2↑
2NaCl  2Na + C12↑
2Na + C12↑
④湿法冶金(又叫水法冶金).利用在溶液中发生的化学反应(如置换、氧化还原、中和、水解等),对原料中的金属进行提取和分离的冶金过程.湿法冶金可用于提取Zn、U(铀)及稀土金属等.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com