
2、硫的氢化物
①硫化氢的制取:
Fe+H2SO4(稀)=FeSO4+H2S↑(不能用浓H2SO4或硝酸,因为H2S具有强还原性)
--H2S是无色、有臭鸡蛋气味的有毒气体;能溶于水,密度比空气略大。
②硫化氢的化学性质
 A.可燃性:当
A.可燃性:当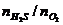 ≥2/1时,2H2S+O2
点燃 2S+2H2O(H2S过量)
≥2/1时,2H2S+O2
点燃 2S+2H2O(H2S过量)
 当
当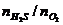 ≤2/3时,2H2S+3O2
点燃 2SO2+2H2O(O2过量)
≤2/3时,2H2S+3O2
点燃 2SO2+2H2O(O2过量)
当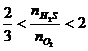 时,两种反应物全部反应完,而产物既有硫又有SO2
时,两种反应物全部反应完,而产物既有硫又有SO2
B.强还原性:常见氧化剂Cl2、Br2、Fe3+、HNO3、KMnO4等,甚至SO2均可将H2S氧化。
C.不稳定性:300℃以上易受热分解
③H2S的水溶液叫氢硫酸,是二元弱酸。
例1:室温时,H2S和O2的混合气体100mL,点燃后充分反应,剩余25mL,求H2S
和O2的体积比。
解析:剩余的25mL气体可能是什么?①H2S ②O2和SO2 ③SO2
①若H2S过量,余25mL H2S
则参加反应的 =75mL×
=75mL×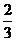 =50mL
=50mL
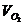 =75mL×
=75mL×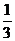 =25mL
=25mL
 :
: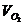 =(50+25):25=3:1
=(50+25):25=3:1
②若为O2和SO2 则O2过量,据:2H2S+3O2 = 2SO2+2H2O △V
2 3 2 3
2LH2S完全反应,体积减少3L,现减少100mL-25mL=75mL
则需H2S的体积为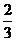 ×75mL=50mL,O2的体积为75mL,75mL+50mL>100mL,不可能。
×75mL=50mL,O2的体积为75mL,75mL+50mL>100mL,不可能。
③两种反应物完全反应,产物为S、SO2和H2O
设H2S的体积为aO2的体积为b
则aH2S+bO2=(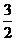 a-b)S+(b-
a-b)S+(b-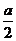 )SO2+aH2O
)SO2+aH2O
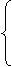 a+b=100
a+b=100
 a=50mL
b=50mL
a=50mL
b=50mL 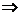 体积比为1:1。
体积比为1:1。
b-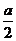 =25
=25
1、硫
(1)物理性质:硫为淡黄色固体;不溶于水,微溶于酒精,易溶于CS2(用于洗去试管壁上的硫);硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。
(2)化学性质:硫原子最外层6个电子,较易得电子,表现较强的氧化性。
①与金属反应(与变价金属反应,均是金属氧化成低价态)
2Na+S===Na2S (剧烈反应并发生爆炸)
 2Al+3S △ Al2S3(制取Al2S3的唯一途径)
2Al+3S △ Al2S3(制取Al2S3的唯一途径)
 Fe+S △ FeS(黑色)
Fe+S △ FeS(黑色)
 2Cu + S △ Cu2S(黑色)
2Cu + S △ Cu2S(黑色)
②与非金属反应
 S+O2 点燃 SO2
S+O2 点燃 SO2
 S+H2 △ H2S(说明硫化氢不稳定)
S+H2 △ H2S(说明硫化氢不稳定)
③与化合物的反应
 S+6HNO3(浓) △ H2SO4+6NO2↑+2H2O
S+6HNO3(浓) △ H2SO4+6NO2↑+2H2O
 S+2H2SO4(浓) △ 2SO2↑+2H2O
S+2H2SO4(浓) △ 2SO2↑+2H2O
 3S+6NaOH △ 2Na2S+Na2SO3+3H2O(用热碱溶液清洗硫)
3S+6NaOH △ 2Na2S+Na2SO3+3H2O(用热碱溶液清洗硫)
(3)用途:大量用于制造硫酸、硫化天然橡胶,也用于制药和黑火药。
2、过量计算问题的判断法
(1) 计算法
(2) 比较法
(3) 极限判断法
(4) 中值判断法(过量讨论)
例2:58.5 g氯化钠跟17 g硝酸银在水溶液里发生反应,可生成多少摩氯化银沉淀?
解析:这是最简单的过量问题。这种题的解题思路是先要选量。选量的目的是确定反应物中过量物质和完全反应的物质。然后以完全反应的物质的量计算有关的量。要从物质的量观点去选量为好,可用物质的量的关系确定完全反应的物质和过量的物质。
n(NaCl)=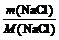 =
=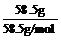 =1 mol,
=1 mol,
n(AgNO3)= =
=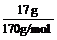 =0.1 mol,
=0.1 mol,
由NaCl+AgNO3=NaNO3+AgCl¯可知:NaCl过量,应以AgNO3计算。
n(AgCl)=n(AgNO3)=0.1 mol
答:能生成0.1mol氯化银沉淀。
当然更为简单的方法是比较大小,而不直接算出具体的数字。如:
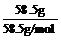 >
>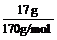 ,NaCl过量,应以AgNO3计算。
,NaCl过量,应以AgNO3计算。
例3:将a g H2与b g Cl2合成制得HCl气体,将反应所得的混合气体用足量NaOH溶液充分吸收。求:
(1) 剩余气体的质量;
(2) 混合气体与NaOH溶液反应所得NaCl的质量。
解析:这是属于第二种类型的一般过量讨论题。由于H2与Cl2的量皆已知,因此,反应后就存在三种情况:。完全反应、H2过量,Cl2过量。而反应后生成的HCl与Cl2能与NaOH溶液反应。
Cl 2+H2=2HCl
HCl+NaOH=NaCl+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
讨论:
① 若氢气与氯气恰好完全反应(或a∶b = 1∶35.5)时,无剩余气体,生成NaCl质量为:117b / 71(g);
② 若Cl2过量(或a∶b<1∶35.5=时,无气体剩余,生成NaCl质量为:58.5(35.5a+b) / 71(g);
③ 若氢气过量(或a∶b>1∶35.5)时,剩余气体为:(a-b / 35.5) g, 生成NaCl质量为:117b / 71 (g)
1、一般的过量计算: 两种物质反应,两反应物的量皆已知,求生成物的量,这是最简单的过量问题。这种题的解题思路是先选量,然后以完全反应的反应物的量计算有关量。选量的方法有多种,以采用物质的量进行比较为好。
3、卤素间的置换反应及X-离子的检验:
(1)Cl2 + 2Br- = Br2 + 2Cl-
Cl2 + 2I- = I2 + 2Cl-
Br2 + 2I- = I2 + 2Br-
结论:氧化性:Cl2 > Br2 > I2; 还原性:I- > Br- > Cl-
(2)溴和碘在不同溶剂中所生成溶液(由稀到浓)的颜色变化
 溶剂 溶剂溶质 |
水 |
苯 |
汽 油 |
四氯化碳 |
|
Br2 |
黄 → 橙 |
橙 → 橙红 |
橙 → 橙红 |
橙→ 橙红 |
|
I2 |
深黄→ 褐 |
淡紫 → 紫红 |
淡紫→ 紫红 |
紫→ 深紫 |
 密
度 密
度 |
|
比 水 轻 |
比 水 轻 |
比 水 重 |
(3)X-离子的检验
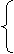 Cl-
白色沉淀
Cl-
白色沉淀
 Br- + AgNO3 +
HNO3
浅黄色沉淀
Br- + AgNO3 +
HNO3
浅黄色沉淀
I- 黄色沉淀
2、卤素元素的有关特性:
(1)F2遇水发生置换反应,生成HF并放出O2。
(2)HF是弱酸、剧毒,但能腐蚀玻璃4HF + SiO2 == SiF4↑ + 2H2O;HF由于形成分子间氢键相互缔合,沸点反常的高。
(3)溴是唯一的液态非金属,易挥发,少量的液溴保存要用水封。
(4)碘易升华,遇淀粉显蓝色;碘的氧化性较弱,它与变价金属反应时生成低价化合物。
(5)AgX中只有AgF溶于水,且不具有感光性;CaF2中只有CaF2难溶。
1、卤素及化合物的性质比较:
|
|
|
氟 |
氯 |
溴 |
碘 |
|
单质物理性质 |
状态 |
气 |
气(易液化) |
液(易挥发) |
固(易升华) |
|
熔、沸点 |
熔、沸点逐渐升高 |
||||
|
颜色 |
淡黄绿色 |
黄绿色 |
红棕色 |
紫黑色 |
|
|
密度 |
密度逐渐增大 |
||||
|
X2与H2化合 |
条件 |
冷暗处 |
光照 |
加热 |
持续加热 |
|
程度 |
剧烈爆炸 |
爆炸 |
缓慢 |
化合同时分解 |
|
|
X2与H2O化合 |
反应 |
2F2+2H2O=4HF+O2 |
X2
+ H2O = HX + HXO |
||
|
程度 |
剧烈 |
缓慢 |
微弱 |
极弱 |
|
|
水溶性 |
|
反应生成氢氟酸 |
水溶性依次减小,有机溶剂中溶解性依次增大 |
||
|
化合价 |
|
只有-1价 |
有-1、+1、+3、+5、+7等 |
||
|
含氧酸 |
化学式 |
无含氧酸 |
有HXO、HXO2、HXO3、HXO4等 |
||
|
强弱程度 |
|
同一价态的酸性依次减弱 |
|||
|
卤化银 |
颜色 |
AgF(白) |
AgCl(白) |
AgBr(淡黄) |
AgI(黄) |
|
水溶性 |
易溶 |
均难溶,且溶解度依次减小 |
|||
|
感光性 |
难分解 |
见光均易分解,且感光性逐渐增强 |
3、氯化氢的实验室制法
(1)药品及反应原理:
NaCl + H2SO4 === NaHSO4 + HCl↑ (不加热或微热)
△
NaHSO4 + NaCl === Na2SO4 + HCl↑ (加热到500ºC-600ºC)
△
总式: 2NaCl + H2SO4 === Na2SO4 + 2HCl↑
(2)装置: 与制氯气的装置相似
(3)收集方法: 向上排空气法
(4)检验方法: 用湿润的蓝色石蕊试纸是否变红或用玻璃棒蘸浓氨水靠近是否有白烟产生
(5)尾气处理: 用水吸收(倒扣漏斗)
2、盐酸的化学性质: (挥发性强酸的通性)
1、物理性质: 无色、有刺激性气味的气体;极易溶于水 (1:500)其水溶液为盐酸。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com