
(二)原电池正、负极的确定
1.由两极的相对活泼性确定:相对活泼性较强的金属为负极,一般地,负极材料与电解质溶液要能发生反应。
2.由电极变化情况确定:某一电极若不断溶解或质量不断减少,该电极发生氧化反应,则此电极为负极;若某一电极上有气体产生、电极的质量不断增加或不变,该电极发生还原反应,则此电极为正极,燃料电池除外。
(一)原电池的判定
1.先分析有无外接电源,有外接电源的是电解池,无外接电源的可能为原电池;然后依据原电池的形成条件分析判断,主要是四看:
(1)看电极--两极为导体且存在活泼性差异(燃料电池的电极一般为惰性电极)
(2)看溶液--两极插在溶液中
(3)看回路--形成闭合回路或两极直接接触
(4)看本质--有无氧化还原发生
2.多池相连,但无外接电源时,两极活泼性差异最大的一池为原电池,其他各池可看作电解池
3.金属的保护
(1)在金属表面覆盖保护层(如油漆、搪瓷、陶瓷、沥青、塑料、橡胶、电镀、钝化等)
(2)电化学保护法
(3)改变金属的内部组织结构
|
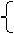 化学腐蚀:腐蚀过程中无电流产生
化学腐蚀:腐蚀过程中无电流产生
电化学腐蚀:腐蚀过程中有电流产生
2.钢铁腐蚀的电化学原理
(1)析氢腐蚀(酸性较强环境中)
负极:Fe → Fe2+ + 2e-
正极:2H+ + 2e- → H2↑
电池反应为 Fe + 2H+ == Fe2+ + H2↑
(2)吸氧腐蚀(中性或酸性很弱环境中)
负极: Fe → Fe2+ + 2e-
正极:2H2O + O2 + 4e- → 4OH-
电池反应为 2Fe+ O2 + 2H2O == Fe(OH)2
3.氢氧燃料电池(以KOH为电解质溶液)
负极2H2 + 4OH- → 4H2O + 4e-
正极 O2 + 2H2O + 4e- → 4OH-
电池反应 2H2 + O2 == 2H2O
2. 铅蓄电池
铅蓄电池
 负极Pb +
负极Pb +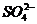 PbSO4 +2e-
PbSO4 +2e-

 正极 PbO2
+ 4H+ +
正极 PbO2
+ 4H+ + 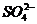 + 2e- PbSO4
+ 2H2O
+ 2e- PbSO4
+ 2H2O

 电池反应PbO2
+ Pb + 2H2SO4
2PbSO4 + 2H2O
电池反应PbO2
+ Pb + 2H2SO4
2PbSO4 + 2H2O
1.锌锰干电池
负极Zn +2OH- → Zn(OH)2 +2e-
正极2MnO2(S)+ H2O(l)+ 2e -→ Mn2O3 + 2OH-
电池反应为: Zn +2MnO2 +H2O == Zn(OH)2 + Mn2O3
5.能量转化:化学能转化为电能 (提供电流)
外电路 电子移动方向:负极→正极; 电流方向:正极→负极
4.电极反应
负极:失电子--氧化反应
正极:得电子--还原反应
3.电极判断
负极:失电子的电极(较活泼的金属)
正极:得电子的电极(较不活泼的金属或非金属)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com